 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Кинетика оксигенирования миоглобина и гемоглобина
|
|
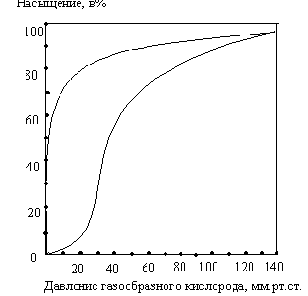 |
Почему миоглобин не способен транспортировать кислород, но зато активно его запасает? Для миоглобина изотерма адсорбции кислорода имеет форму гиперболы. Давление О2 в ткани, окружающей легочные капилляры, составляет 100 мм рт.ст., поэтому миоглобин в легких мог бы весьма эффективно насыщаться кислородом. В венозной крови Р О2 равно 40 мм рт. ст., а в активно работающей мышце - 20 мм рт.ст. Но даже при парциальном давлении 20 мм рт. ст. степень насыщения миоглобина кислородом будет весьма значительна, и поэтому миоглобин не может служить транспортной молекулой для доставки О2 от легких к периферическим тканям. Однако при кислородном голодании, которым сопровождается тяжелая физическая работа, парциальное давление О2 в тканях может понизиться и до 5 мм рт.ст.; при столь низком давлении миоглобин легко отдает кислород, обеспечивая тем самым окислительный синтез АТФ в митохондриях мышечных клеток.
Кинетика оксигенирования гемоглобина коренным образом отличается от кинетики оксигенирования миоглобина. Кривая насыщения гемоглобина О2 имеет сигмоидальную форму. Т.о., способность гемоглобина связывать О2 зависит от того, содержатся ли в данном тетрамере другие молекулы О2. Если да, то последующие молекулы О2 присоединяются легче. Для гемоглобина характерна кинетика кооперативного связывания, благодаря которой он связывает максимальное количество О2 в легких и отдает максимальное количество О2 при тех значениях Р О2, которые имеют место в периферических тканях.
Сродство гемоглобинов к О2 характеризуется величиной Р50- значением парциального давления О2, при котором наблюдается полунасыщение гемоглобина кислородом. Например, для HbA Р50 = 26 мм рт.ст., а для HbF - 20 мм рт. ст. Благодаря этой разнице гемоглобин F отбирает кислород у HbA, находящегося в плацентарной крови.
2) У олигомерных белков имеется специальный центр, отличный от активного, к которому присоединяется аллостерический лиганд. Этот центр получил название аллостерического.
Рассмотрим аллостерическую регуляцию на примере HbА. В центре молекулы HbА находится полость, которая является местом присоединения 2,3-ДФГ. Это соединение накапливается в эритроцитах при недостатке О2. Непосредственным предшественником служит 1,3-дифосфоглицерат - промежуточный продукт гликолиза. 2,3-ДФГ имеет сильный отрицательный заряд и взаимодействует с 5 положительно заряженными группами аллостерического центра. В результате взаимодействия образуется 5 дополнительных ионных связей, что снижает сродство Hb к кислороду и облегчает его отдачу в ткани.
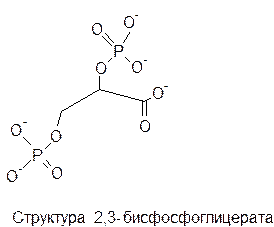
Кооперативные изменения конформации олигомерных белков составляют основу механизма регуляции функциональной активности не только Hb, но и большого числа других белков, в том числе аллостерических ферментов.
Дата публикования: 2015-11-01; Прочитано: 1183 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
