 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
политропный процесс
|
|
Политропный процесс, политропический процесс — термодинамический процесс, во время которого удельная теплоёмкость газа остаётся неизменной.
В соответствии с сущностью понятия теплоёмкости 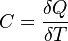 , предельными частными явлениями политропного процесса являются изотермический процесс (
, предельными частными явлениями политропного процесса являются изотермический процесс (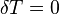 ) и адиабатный процесс (
) и адиабатный процесс (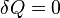 ).
).
В случае идеального газа, изобарный процесс и изохорный процесс также являются политропными (удельные теплоёмкости идеального газа при постоянном объёме и постоянном давлении соответственно равны 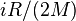 и (
и (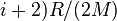 и не меняются при изменении термодинамических параметров).
и не меняются при изменении термодинамических параметров).
Кривая на термодинамических диаграммах, изображающая политропный процесс, называется «политропа». Для идеального газа уравнение политропы может быть записано в виде:
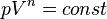
где р — давление, V — объем газа, n — «показатель политропы».
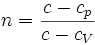 . Здесь
. Здесь  — теплоёмкость газа в данном процессе,
— теплоёмкость газа в данном процессе,  и
и 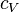 — теплоемкости того же газа, соответственно, при постоянном давлении и объеме.
— теплоемкости того же газа, соответственно, при постоянном давлении и объеме.
В зависимости от вида процесса, можно определить значение n:
· Изотермический процесс: 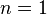 , так как
, так как 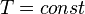 , значит, по закону Бойля — Мариотта
, значит, по закону Бойля — Мариотта  , и уравнение политропы вынуждено выглядеть так:
, и уравнение политропы вынуждено выглядеть так:  .
.
· Изобарный процесс: 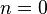 , так как
, так как 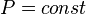 , и уравнение политропы вынуждено выглядеть так:
, и уравнение политропы вынуждено выглядеть так: 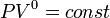 .
.
· Адиабатный процесс: 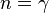 (здесь
(здесь  — показатель адиабаты), это следует из уравнения Пуассона.
— показатель адиабаты), это следует из уравнения Пуассона.
· Изохорный процесс: 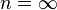 , так как
, так как  , и в процессе
, и в процессе 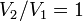 , а из уравнения политропы следует, что
, а из уравнения политропы следует, что 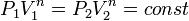 , то есть, что
, то есть, что 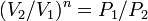 , то есть
, то есть 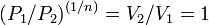 , а это возможно, только если
, а это возможно, только если 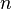 является бесконечным.
является бесконечным.
| Значение показателя политропы | Уравнение | Описание процесса |
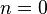
| 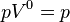
| Это изобарный процесс (протекающий при постоянном давлении) |
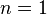
| 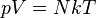
| Это изотермический процесс (протекающий при постоянной температуре) |

| — | Это квазиадиабатические процессы, протекающие, например, в двигателях внутреннего сгорания во время расширения газа |
47 Среднее число столкновенний и средняя длина свободного пробега молекул
Обозначим 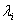 – длина свободного пробега молекулы. Медленность явлений переноса, например диффузии ароматических веществ – «распространение запаха», - при относительно высокой скорости теплового движения молекул (103 м/с) объясняется столкновениями молекул. Молекула газа время от времени сталкивается с другими молекулами. В момент столкновения молекула резко изменяет величину и направление скорости своего движения. Расстояние, проходимое молекулой в среднем без столкновений, называется средней длиной свободного пробега. Средняя длина свободного пробега равна:
– длина свободного пробега молекулы. Медленность явлений переноса, например диффузии ароматических веществ – «распространение запаха», - при относительно высокой скорости теплового движения молекул (103 м/с) объясняется столкновениями молекул. Молекула газа время от времени сталкивается с другими молекулами. В момент столкновения молекула резко изменяет величину и направление скорости своего движения. Расстояние, проходимое молекулой в среднем без столкновений, называется средней длиной свободного пробега. Средняя длина свободного пробега равна: 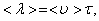
где 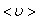 – средняя скорость теплового движения, τ – среднее время между двумя столкновениями. Именно
– средняя скорость теплового движения, τ – среднее время между двумя столкновениями. Именно 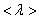 - средняя длина свободного пробега нас интересует
- средняя длина свободного пробега нас интересует
 – площадь, в которую не может проникнуть центр любой другой молекулы. Здесь
– площадь, в которую не может проникнуть центр любой другой молекулы. Здесь 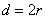 – диаметр молекулы.
– диаметр молекулы.
За одну секунду молекула проходит путь, равный средней арифметической скорости  . За ту же секунду молекула претерпевает ν столкновений. Следовательно,
. За ту же секунду молекула претерпевает ν столкновений. Следовательно,
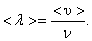
| 3.2.1 |
Подсчитаем число столкновений ν.
Вероятность столкновения трех и более молекул бесконечно мала.
А так как средняя длина свободного пробега 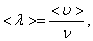 то получим:
то получим:
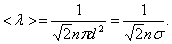
| (3.2.2) |
Уравнение состояния идеального газа позволяет нам выразить n через давление P и термодинамическую температуру Т.
Так как 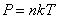 , то есть
, то есть 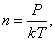 то
то
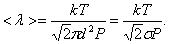
| (3.2.3) |
Таким образом, при заданной температуре средняя длина свободного пробега обратно пропорциональна давлению Р:
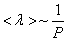
|
48.
В ТД неравновесных системах возникают особые необратимые процессы, называемые явлениями переноса, в результате которых происходит пространственный перенос энергии, массы, импульса и т.д.
1) Теплопроводность обусловлена переносом тепловой энергии в виде кинетической энергии молекул. Если в одной области газа средняя кинетическая энергия молекул больше, чем в другой, то с течением времени вследствие постоянных столкновений происходит процесс выравнивания средней кинетической энергии молекул, т.е. происходит выравнивание температуры. Перенос энергии подчиняется закону Фурье:
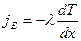 , где
, где 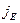 - плотность теплового потока – величина, определяемая энергией, переносимой в форме теплоты в ед. времени через ед. площадку перпендикулярную оси х.
- плотность теплового потока – величина, определяемая энергией, переносимой в форме теплоты в ед. времени через ед. площадку перпендикулярную оси х.
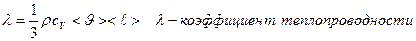
 - градиент температуры, равный скорости изменения температуры. Знак «-» показывает, что при теплопроводности энергия переносится в сторону убывания температуры.
- градиент температуры, равный скорости изменения температуры. Знак «-» показывает, что при теплопроводности энергия переносится в сторону убывания температуры.
2) Диффузия обусловлена переносом массы за счет изменения концентрации. Диффузия происходит при самопроизвольном проникновении и перемешивании частиц 2-х соприкасающихся газов, жидкостей и даже твердых тел. Диффузия существует, пока существует градиент плотности. Явление диффузии подчиняется закону Фика:
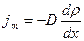 , где
, где 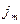 - плотность потока массы – величина, определяемая массой вещества, переносимой в ед. времени через ед. площадку перпендикулярную оси х.
- плотность потока массы – величина, определяемая массой вещества, переносимой в ед. времени через ед. площадку перпендикулярную оси х.

 - градиент плотности, равный скорости изменения плотности. Знак «-» показывает, что при диффузии масса переносится в сторону убывания плотности.
- градиент плотности, равный скорости изменения плотности. Знак «-» показывает, что при диффузии масса переносится в сторону убывания плотности.
3) Внутреннее трение (вязкость) обусловлена переносом импульса за счет импульсов молекул. Механизм возникновения внутреннего трения между параллельными слоями заключ. в том, что из-за хаотического теплового движения происходит обмен молекулами между слоями, в результате чего импульс слоя, движущегося быстрее, уменьшается, а слоя, движущегося медленнее, увеличивается, что приводит к торможению более быстрого слоя и ускорению более медленного. Сила внутреннего трения между двумя слоями подчиняется империческому закону Ньютона:
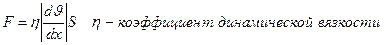
 - градиент скорости, показывающий быстроту изменения скорости в направлении перпендикулярном движению слоев. S – площадь, на которую действует сила F.
- градиент скорости, показывающий быстроту изменения скорости в направлении перпендикулярном движению слоев. S – площадь, на которую действует сила F.
Взаимодействие двух слоев согласно второму закону Ньютона можно рассматривать как процесс, при котором одного слоя к другому в ед. времени передается импульс, по модулю равный действующей силе.
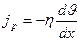 , где
, где  - плотность потока импульса – величина, определяемая полным импульсом вещества, переносимым в ед. времени через ед. площадку перпендикулярную оси х.
- плотность потока импульса – величина, определяемая полным импульсом вещества, переносимым в ед. времени через ед. площадку перпендикулярную оси х.
49. Обратимым процессом называют такой процесс, который может быть проведен в обратном направлении таким образом, что система будет проходить через те же состояния, что и при прямом ходе, но в обратной последовательности. Обратимым может быть только равновесный процесс.
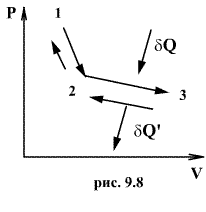
Обратимый процесс обладает следующими свойствами: если при прямом ходе на каком-то элементарном участке (рис. 9.8.) система получает тепло 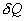 и совершает работу
и совершает работу 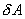 , то при обратном ходе на том же участке система отдает тепло
, то при обратном ходе на том же участке система отдает тепло 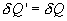 и над ней совершается работа
и над ней совершается работа 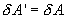 . По этой причине после протекания обратимого процесса в одном, а затем в обратном направлении и возвращение системы в первоначальное состояние в окружающих телах не должно оставаться никаких изменений. Например шарик на пружине в вакууме колеблется бесконечно долго.
. По этой причине после протекания обратимого процесса в одном, а затем в обратном направлении и возвращение системы в первоначальное состояние в окружающих телах не должно оставаться никаких изменений. Например шарик на пружине в вакууме колеблется бесконечно долго.
В том случае, когда после завершения прямого и обратного процессов система вернулась в первоначальное состояние и в окружающей среде остались изменения, процесс является необратимым. Очевидно, что все процессы в природе необратимые.
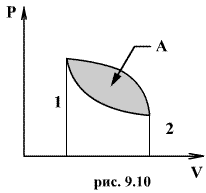
Круговым процессом (или циклом) называется такой процесс при котором система после ряда изменении возвращается в исходное состояние. На графике цикл изображается замкнутой кривой Работа совершаемая при круговом процессе, численно равна площади охватываемой кривой. После совершения цикла система возвращается в прежнее состояние. Поэтому всякая функция состояния, в частности внутренняя энергия, имеет в начале и в конце цикла одинаковое значение.
50 Теплово́й дви́гатель — устройство, совершающее работу за счет использования внутренней энергии, тепловая машина, превращающая тепло в механическую энергию, использует зависимость теплового расширения вещества от температуры. (Возможно использование изменения не только объёма, но и формы рабочего тела, как это делается в твёрдотельных двигателях, где в качестве рабочего тела используется вещество в твёрдой фазе.) Действие теплового двигателя подчиняетсязаконам термодинамики. Для работы необходимо создать разность давлений по обе стороны поршня двигателя или лопастей турбины. Для работы двигателя обязательно наличие топлива. Это возможно при нагревании рабочего тела (газа), которое совершает работу за счёт изменения своей внутренней энергии. Повышение и понижение температуры осуществляется, соответственно, нагревателем и охладителем.
Работа, совершаемая двигателем, равна:
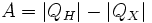 , где:
, где:
· 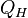 — количество теплоты, полученное от нагревателя,
— количество теплоты, полученное от нагревателя,
· 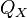 — количество теплоты, отданное охладителю.
— количество теплоты, отданное охладителю.
Коэффициент полезного действия (КПД) теплового двигателя рассчитывается как отношение работы, совершаемой двигателем, к количеству теплоты, полученному от нагревателя: 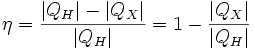
Часть теплоты при передаче неизбежно теряется, поэтому КПД двигателя менее 1. Максимально возможным КПД обладает двигатель Карно. КПД двигателя Карно зависит только от абсолютных температур нагревателя(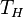 ) и холодильника(
) и холодильника(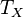 ):
):
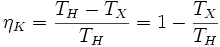
51 Пусть тепловая машина состоит из нагревателя с температурой 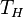 , холодильника с температурой
, холодильника с температурой 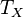 и рабочего тела.
и рабочего тела.
Цикл Карно состоит из четырёх обратимых стадий, две из которых осуществляются при постоянной температуре (изотермически), а две — при постоянной энтропии (адиабатически). Поэтому цикл Карно удобно представить в координатах T (температура) и S (энтропия).
1. Изотермическое расширение (на рис. 1 — процесс A→Б). В начале процесса рабочее тело имеет температуру 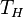 , то есть температуру нагревателя. Затем тело приводится в контакт с нагревателем, который изотермически (при постоянной температуре) передаёт ему количество теплоты
, то есть температуру нагревателя. Затем тело приводится в контакт с нагревателем, который изотермически (при постоянной температуре) передаёт ему количество теплоты 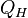 . При этом объём рабочего тела увеличивается, оно совершает механическую работу, а его энтропия возрастает.
. При этом объём рабочего тела увеличивается, оно совершает механическую работу, а его энтропия возрастает.
2. Адиабатическое расширение (на рис. 1 — процесс Б→В). Рабочее тело отсоединяется от нагревателя и продолжает расширяться без теплообмена с окружающей средой. При этом температура тела уменьшается до температуры холодильника 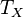 , тело совершает механическую работу, а энтропия остаётся постоянной.
, тело совершает механическую работу, а энтропия остаётся постоянной.
3. Изотермическое сжатие (на рис. 1 — процесс В→Г). Рабочее тело, имеющее температуру 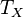 , приводится в контакт с холодильником и начинает изотермически сжиматься под действием внешней силы, отдавая холодильнику количество теплоты
, приводится в контакт с холодильником и начинает изотермически сжиматься под действием внешней силы, отдавая холодильнику количество теплоты 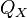 . Над телом совершается работа, его энтропия уменьшается.
. Над телом совершается работа, его энтропия уменьшается.
4. Адиабатическое сжатие (на рис. 1 — процесс Г→А). Рабочее тело отсоединяется от холодильника и сжимается под действием внешней силы без теплообмена с окружающей средой. При этом его температура увеличивается до температуры нагревателя, над телом совершается работа, его энтропия остаётся постоянной.
Количество теплоты, полученное рабочим телом от нагревателя при изотермическом расширении, равно
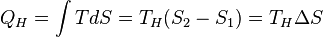 .
.
Аналогично, при изотермическом сжатии рабочее тело отдаёт холодильнику
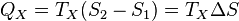 .
.
Отсюда коэффициент полезного действия тепловой машины Карно равен
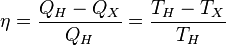 .
.
· 52. Постулат Клаузиуса: «Невозможен круговой процесс, единственным результатом которого является передача теплоты от менее нагретого тела к более нагретому» [1] (такой процесс называется процессом Клаузиуса).
· Постулат Томсона (Кельвина): «Невозможен круговой процесс, единственным результатом которого было бы производство работы за счет охлаждения теплового резервуара» (такой процесс называется процессом Томсона).
Ограничения
С точки зрения статистической физики второе начало термодинамики имеет статистический характер: оно справедливо для наиболее вероятного поведения системы. Существование флуктуаций препятствует точному его выполнению, однако вероятность сколь-нибудь значительного нарушения крайне мала.
Эквивалентность этих формулировок легко показать. В самом деле, допустим, что постулат Клаузиуса неверен, то есть существует процесс, единственным результатом которого была бы передача тепла от более холодного тела к более горячему. Тогда возьмем два тела с различной температурой (нагреватель и холодильник) и проведем несколько циклов тепловой машины, забрав тепло  у нагревателя, отдав
у нагревателя, отдав 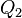 холодильнику и совершив при этом работу
холодильнику и совершив при этом работу 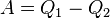 . После этого воспользуемся процессом Клаузиуса и вернем тепло
. После этого воспользуемся процессом Клаузиуса и вернем тепло 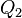 от холодильника нагревателю. В результате получается, что мы совершили работу только за счет отъёма теплоты от нагревателя, то есть постулат Томсона тоже неверен.
от холодильника нагревателю. В результате получается, что мы совершили работу только за счет отъёма теплоты от нагревателя, то есть постулат Томсона тоже неверен.
53. Второе начало термодинамики (в формулировке неубывания энтропии) иногда используется критиками эволюционной теории с целью показать, что развитие природы в сторону усложнения невозможно[5][6]. Однако подобное применение физического закона является некорректным, так как энтропия не убывает только в замкнутых системах (сравн. с диссипативной системой), в то время как живые организмы и планета Земля в целом являются открытыми системами.
В процессе жизнедеятельности живые организмы превращают энергию одного вида (электромагнитную солнечную, химическую) в энергию другого вида (тепловую), тем самым ускоряя суммарное увеличение энтропии Вселенной. Несмотря на «локальное» уменьшение энтропии путем «упорядоченных» процессов, происходит суммарное увеличение энтропии вселенной, а живые организмы являются в некотором роде катализаторами этого процесса. Таким образом, наблюдается выполнение второго закона термодинамики и нет никакого парадокса возникновения и существования живых организмов вопреки глобальной тенденции вселенной к увеличению «беспорядка».
Пусть Земля получает от Солнца за единицу времени энергию 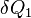 в виде излучения с температурой
в виде излучения с температурой 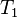 , а излучает энергию
, а излучает энергию 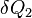 в виде излучения с температурой
в виде излучения с температурой 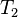 . Тогда приращение энтропии составляет
. Тогда приращение энтропии составляет 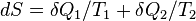 . Сколько Земля получает энергии за единицу времени, столько она и излучает в космическое пространство. Поэтому
. Сколько Земля получает энергии за единицу времени, столько она и излучает в космическое пространство. Поэтому 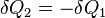 , и изменение энтропии составляет
, и изменение энтропии составляет 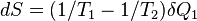 . Основная часть энергии, получаемой от Солнца, приходится на видимый оптический диапазон, в то время как излучает Земля в более длинноволновом, инфракрасном диапазоне (не следует путать отражаемый Землёй солнечный свет и излучение самой Земли). Следовательно,
. Основная часть энергии, получаемой от Солнца, приходится на видимый оптический диапазон, в то время как излучает Земля в более длинноволновом, инфракрасном диапазоне (не следует путать отражаемый Землёй солнечный свет и излучение самой Земли). Следовательно, 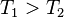 , и изменение энтропии отрицательно:
, и изменение энтропии отрицательно: 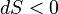 . Другими словами, уходящее от Земли излучение обладает большей энтропией, чем приходящее, и оно уносит энтропию от Земли. Поэтому локально энтропия на Земле может убывать. Но при этом энтропия полной системы, включающей в себя помимо Земли также космическое пространство, с которым Земля обменивается энергией, возрастает.
. Другими словами, уходящее от Земли излучение обладает большей энтропией, чем приходящее, и оно уносит энтропию от Земли. Поэтому локально энтропия на Земле может убывать. Но при этом энтропия полной системы, включающей в себя помимо Земли также космическое пространство, с которым Земля обменивается энергией, возрастает.
54 Реальный газ — газ, который не описывается уравнением состояния идеального газа Клапейрона — Менделеева.
Зависимости между его параметрами показывают, что молекулы в реальном газе взаимодействуют между собой и занимают определенный объём. Состояние реального газа часто на практике описывается обобщённым уравнением Менделеева — Клапейрона:

где p — давление; V — объем; T — температура; Zr = Zr (p,T) — коэффициент сжимаемости газа; m — масса; М — молярная масса; R — газовая постоянная.
Термическим уравнением состояния (или, часто, просто уравнением состояния) называется связь между давлением, объёмом и температурой.
Для одного моля газа Ван-дер-Ваальса оно имеет вид:
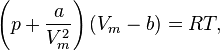
Видно, что это уравнение фактически является уравнением состояния идеального газа с двумя поправками. Поправка 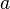 учитывает силы притяжения между молекулами (давление на стенку уменьшается, так как есть силы, втягивающие молекулы приграничного слоя внутрь), поправка
учитывает силы притяжения между молекулами (давление на стенку уменьшается, так как есть силы, втягивающие молекулы приграничного слоя внутрь), поправка 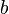 — объем молекул газа.
— объем молекул газа.
Для 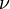 молей газа Ван-дер-Ваальса уравнение состояния выглядит так:
молей газа Ван-дер-Ваальса уравнение состояния выглядит так:
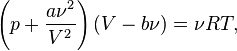
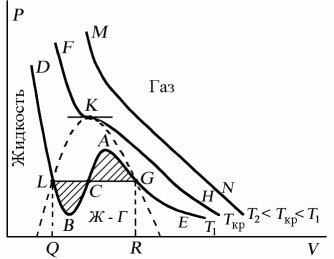
56. При очень высоких температурах они имеют форму, близкую к гиперболам  ; эти изотермы характеризуют газообразное состояние вещества (почти идеальный газ). По мере уменьшения температуры форма изотермы изменяется и при некоторой температуре
; эти изотермы характеризуют газообразное состояние вещества (почти идеальный газ). По мере уменьшения температуры форма изотермы изменяется и при некоторой температуре 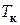 (критическая) обнаруживает точку
(критическая) обнаруживает точку 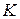 перегиба кривой. При еще меньших температурах (докритических) изотермы вместо горизонтального участка, соответствующего фазовому переходу жидкость – пар, имеют волнообразный участок
перегиба кривой. При еще меньших температурах (докритических) изотермы вместо горизонтального участка, соответствующего фазовому переходу жидкость – пар, имеют волнообразный участок  (рис. 53).
(рис. 53).
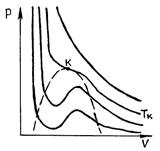

Р и с. 52 Р и с. 53
Измерения показывают, что изотермы реального вещества практически совпадают с изотермой Ван-дер-Ваальса на участках  (газообразное состояние) и
(газообразное состояние) и  (жидкое состояние). Однако в средней части вместо горизонтального участка 51, соответствующего фазовому переходу жидкость – пар, изотерма Ван-дер-Ваальса имеет волнообразный участок
(жидкое состояние). Однако в средней части вместо горизонтального участка 51, соответствующего фазовому переходу жидкость – пар, изотерма Ван-дер-Ваальса имеет волнообразный участок 
57 Внутренняя энергия реального газа будем определяться суммой кинетической энергии Eк теплового движения его молекул и потенциальной энергии взаимодействия молекул между собой - Eп:
U=Eк+Eп.
Потенциальная энергия реального газа обусловлена только силами притяжения между молекулами. Наличие последних приводит к возникновению внутреннего давления p' на газ.
Работа, затрачиваемая на преодоления сил притяжения, равна приращению энергии. Следовательно, можно записать:
δA=dEп=p'dV=(a/Vm2)dVm
Проинтегрировав это уравнение, получим:
Eп=-a/Vm
(постоянная интегрирования принята равной нулю). Знак минус означает, что молекулярные силы, создающие дополнительное давление, являются силами притяжения. Окончательно внутренняя энергия моля реального газа:
Um=CvT-(a/Vm) (73)
Из формулы для внутренней энергии реального газа следует, что его внутренняя энергия растет как с увеличением температуры, так и с увеличением объема. Если реальный газ будет расширяться или сжиматься адиабатически и без совершения внешней работы, то для него, согласно первому началу термодинамики:
ΔQ=ΔU+ΔA; ΔQ=0, ΔA=0; ⇒ ΔU=0 → U=const,
и внутренняя энергия должна оставаться постоянной.
Поэтому, из формулы (73) для реального газа, совершающего адиабатический переход без совершения работы, можно записать:
T1-T2=(a/Cv)[(1/Vm1)-(1/Vm2)] (74)
Из этого уравнения следует, что изменение объема и изменение температуры имеют разные знаки. Следовательно, при адиабатическом расширении в вакуум, реальный газ должен охлаждаться, а при сжатии - нагреваться.
Отметим, что для идеального газа этот эффект не наблюдается:
ΔU=CvΔT=0 → ΔT=0 → T=const
58 Поверхностное натяжение. Жидкость не заполняет весь объем сосуда, в который она налита. Между жидкостью и газом (или паром) образуется граница раздела. Молекулы в поверхностном слое жидкости (2), в отличие от молекул в ее глубине (1), окружены другими молекулами не со всех сторон. Силы межмолекулярного взаимодействия, действующие на одну из молекул внутри жидкости взаимно скомпенсированы. Любая молекула в поверхностном слое притягивается молекулами, находящимися внутри жидкости. В результате появляется некоторая равнодействующая сила, направленная вглубь жидкости. Под действием этой силы молекулы жидкости стремятся уйти из поверхностного слоя и жидкость стремится принять форму с наименьшей площадью поверхности. (В отсутствие других сил форму шара.) Сила поверхностного натяжения. Силой поверхностного натяжения- называется сила, направленная вдоль границы поверхности жидкости перпендикулярно ее границе и стремящаяся уменьшить площадь поверхности жидкости. Fп.н. Коэффициент σ называется коэффициентом поверхностного натяжения (σ > 0). Н/ м Коэффициент поверхностного натяжения зависит от: 1. Рода жидкости. 2. Наличия примеси. 3. Температуры.(T) Наличие сил поверхностного натяжения делает поверхность жидкости похожей на упругую растянутую пленку, с той только разницей, что упругие силы в пленке зависят от площади ее поверхности (т. е. от того, как пленка деформирована), а силы поверхностного натяжения не зависят от площади поверхности жидкости. Явление смачивания. Форма свободной поверхности жидкости зависит от сил взаимодействия молекул жидкости с молекулами твердого тела. Если эти силы больше сил взаимодействия между молекулами самой жидкости, то жидкость смачивает поверхность твердого тела. Жидкость подходит к поверхности твердого тела под углом θ, характерным для данной пары жидкость – твердое тело. Угол θ называется краевым углом. При /2 жидкость смачивает твердое тело. При /2 жидкость не смачивает твердое тело. Капиллярные явления. Капиллярными явлениями называют подъем или опускание жидкости в трубках малого диаметра – капиллярах. Смачивающие жидкости поднимаются по капиллярам, несмачивающие – опускаются. Пусть капиллярная трубка радиуса r, опущена нижним концом в смачивающую жидкость плотности ρ. Верхний конец капилляра открыт. Подъем жидкости в капилляре продолжается до тех пор, пока сила тяжести действующая на столб жидкости в капилляре, не станет равной по модулю силе поверхностного натяжения, действующей вдоль границы соприкосновения жидкости с поверхностью капилляра
59 Уравнение Лапласа — дифференциальное уравнение в частных производных. В трёхмерном пространстве уравнение Лапласа записывается так:
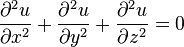
и является частным случаем уравнения Гельмгольца.
Уравнение рассматривают также в двумерном и одномерном пространстве. В двумерном пространстве уравнение Лапласа записывается:
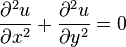
Если поверхность жидкости не плоская, а искривленная, то она оказывает на жидкость избыточное (добавочное)давление.Это давление, обусловленное силами поверхностного натяжения, для выпуклой поверхности положительно, а для вогнутой поверхности – отрицательно.
Для расчета избыточного давления предположим, что свободная поверхность жидкости имеет форму сферы радиуса R (Рис.10.3),от которой отсечен шаровой сегмент, опирающийся на окружность радиуса r=Rsinα.
Рис.10.3. На каждый бесконечно малый элемент длины Δl этого контура действует сила поверхностного натяжения ΔF=σΔl, касательная к поверхности сферы. Разложив ΔF на два компонента (ΔF1 и ΔF2), видим, что геометрическая сумма сил ΔF2равна нулю, так как эти силы на противоположных сторонах контура направлены в обратные стороны и взаимно уравновешиваются. Поэтому равнодействующая сил поверхностного натяжения, действующих на вырезанный сегмент, направлена перпендикулярно плоскости сечения внутрь жидкости и равна алгебраической сумме составляющих ΔF1:
F=∑ ΔF1= ∑ΔF sin α=∑σΔl r/R= ∑Δl = σr/R 2πr.
Разделив эту силу на площадь основания сегмента πr2, вычислим избыточное (добавочное) давление на жидкость, создаваемое силами поверхностного натяжения и обусловленное кривизной поверхности:
Δр =F/S= 2σ πr2/R πr 2=2σ/R. (10.4)
Если поверхность жидкости вогнутая, то можно доказать, что результирующая сила поверхностного натяжения направлена из жидкости и равна
Δр= -2σ/R.
Следовательно, давление внутри жидкости под вогнутой поверхностью меньше, чем в газе, на величину Δр.
Формулы являются частным случаемформулы Лапласа, определяющей избыточное давление для произвольной поверхности жидкости двоякой кривизны:
Δр=σ(1/R1+1/R2), (10.5)
где R1 и R2 — радиусы кривизны двух любых взаимно-перпендикулярных нормальных сечений поверхности жидкости в данной точке. Радиус кривизны положителен, если центр кривизны соответствующего сечения находится внутри жидкости, и отрицателен, если центр кривизны находится вне жидкости.
Для сферической искривленной поверхности (R1=R2=R) выражение (10.5) переходит в записанное ранее (10.4), для цилиндрической (R1=R и R2=∞) - избыточное давление Δp=σ/R.
Для плоской поверхности (R1=R2=∞) силы поверхностного натяжения избыточного давления не создают.
60 Для капиллярных сосудов характерна прежде всего кривизна поверхности жидкости в них, поэтому в таких сосудах в полной мере проявляются эффекты, обусловленные избыточным давлением Лапласа. К числу таких эффектов относится капиллярный подъем.
Найдем высоту поднятия жидкости в цилиндрической капиллярной трубочке радиуса r. Пусть жидкость смачивает поверхность трубочки, вследствие чего в последней образуется симметричный вогнутый мениск с радиусами кривизны двух взаимно перпендикулярных сечений 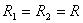 . Отметим еще, что изменением давления жидкости при ее поднятии на высоту порядка r будем пренебрегать. В этом приближении давление во всех точках мениска можно считать одинаковым.
. Отметим еще, что изменением давления жидкости при ее поднятии на высоту порядка r будем пренебрегать. В этом приближении давление во всех точках мениска можно считать одинаковым.
Под искривленной поверхностью вогнутого мениска давление в жидкости, как это было рассмотрено выше, меньше атмосферного давления Р 0 на величину давления Лапласа 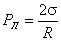 .
.
Условие равновесия жидкости в капиллярной трубочке определяется равенством
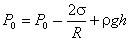 . .
| (6.23) |
 . .
| (6.24) |
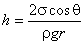 . .
| (6.26) |
Полученная формула, определяющая высоту поднятия жидкости в капиллярной трубочке, носит название формулы Жюрена. Очевидно, что чем меньше радиус трубки, тем на большую высоту поднимается в ней жидкость. Кроме того, высота поднятия растет с увеличением коэффициента поверхностного натяжения жидкости.
В частном случае для жидкости, полностью смачивающей стенки капилляра 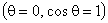 , формула Жюрена принимает вид:
, формула Жюрена принимает вид:
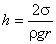 . .
|
| Рис. 6.19 |
Капиллярный подъем может наблюдаться не только в цилиндрических капиллярах. Жидкость поднимается и между двумя пластинами, разделенными узким зазором (рис. 6.19). Если пластины параллельны друг другу, то мениск имеет цилиндрическую форму с радиусом кривизны одного из сечений, равным  . Радиус кривизны другого нормального сечения цилиндрического мениска можно считать равным бесконечности. При этом условии высота поднятия жидкости между пластинами равна:
. Радиус кривизны другого нормального сечения цилиндрического мениска можно считать равным бесконечности. При этом условии высота поднятия жидкости между пластинами равна:
Дата публикования: 2015-11-01; Прочитано: 1622 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
