 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Составление теплового баланса процесса экстракции фосфорной кислоты
|
|
Приход теплоты
Суммарная теплота определяется теплотами, вносимыми: апатитом (Qan), серной кислотой (Qск), раствором разбавления (Qp.p), а также теплотами реакции (Qp) и разбавления серной кислоты в экстракторе (Qpaзб). Кроме того, теплоту вносит поступающий воздух (Qвозд) и циркулирующая пульпа (Qц.п.). Итак:
Qприх = Qan + Qск + Qp.p + Qp + Qpaзб + Qвозд + Qц.п.
Определим эти теплоты:
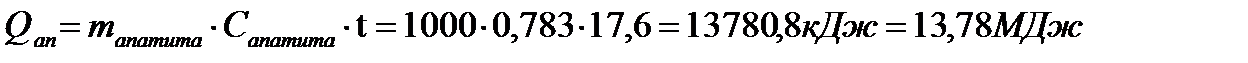
(Cапатита (0,783) — удельная теплоемкость апатитового концентрата, кДж/(кг • К); 17,6 — средняя температура в Северо-Западном районе в июле, т. е. в период наиболее напряженного теплового режима цеха, °С).
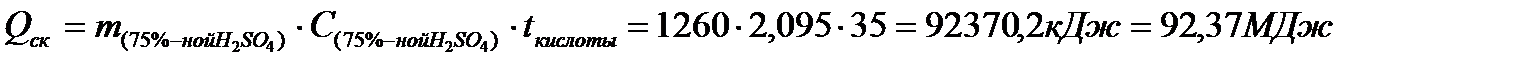
[С75%-ной Н2SO4 — удельная теплоемкость 75%-ной H2S04, кДж/(кг-К) при 35°С, рассчитывается по формуле: С75%-ной Н2SO4 = ХН2О*СН2О + ХН2SО4 *СН2SО4 = 4,17825*0,25 + 1,4*0,75 = 2,095 кДж/(кг-К); 35 — температура кислоты, °С];
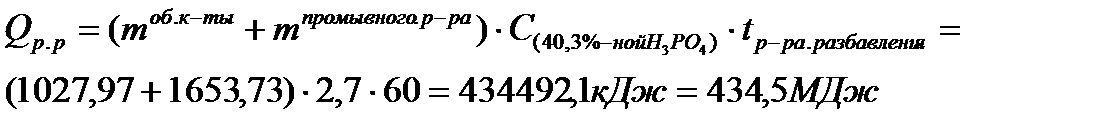
(С40,3%-ной Н3РO4 — удельная теплоемкость раствора разбавления фосфорной кислоты концентрации 40,3% Н3Р04, кДж/(кг-К) при 60°С, рассчитывается по формуле: С40,3%-ной Н3РO4 = ХН2О*СН2О + ХН3РО4 *СН3РО4 = 0,403*0,493 + 0,597 *4,1841 = 2,7 кДж/(кг-К), 60 — температура поступающего раствора разбавления, °С).
Тепловой эффект реакции взаимодействия серной кислоты с апатитовым концентратом (при условии, что вся Р205 в апатитовом концентрате находится в виде фторапатита)
Ca5F(Р04)3 + 5H2S04 +10Н20 = 5CaS04*2H20 + ЗН3Р04 + HF + q
определяем по закону Гесса:
q = (5*2022,6 + 3*1278,2 + 269,6) – (6828,7 + 5*839,5 +10-286,4) =
= 14 217,2 — 13 890,2 = 327 кДж/кмоль
Здесь значения теплот образования реагирующих веществ и образующихся продуктов реакции равны, в кДж/кмоль:
CaS04* 2H20 (tb.) 2022,6 Ca5F(P04)3 (tb.) 6828,7
H3P04 (p-p) 1278,2 H2SO4 (p-p) 839,5
HF (г.) 269,6 H20 (ж.) 286,4
Отсюда:

(0,98 — степень разложения фторапатита, доля единицы;  — молекулярная масса фторапатита).
— молекулярная масса фторапатита).
Теплоту разбавления в экстракторе 75%-ной H2S04 определяем по формуле:

Здесь GH — часовое количество серной кислоты, поступающей в экстрактор, кг.
Удельную теплоту разбавления серной кислоты q определяем по формуле:
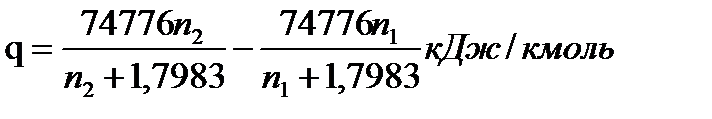
Здесь п 1 и n2 — мольное отношение Н20: H2S04 в исходном и конечном растворах серной кислоты (до и после разбавления в экстракторе):
n1= (25*98)/(18*75) = 1, 82 кмоль Н20/кмоль H2S04
Для определения п2 необходимо знать концентрацию серной кислоты С2 после разбавления в экстракторе (в предположении, что взаимодействие кислоты с апатитом происходит после смешения ее с другими жидкими компонентами). Эту концентрацию определяют по данным материального баланса, составленного на 1000 кг апатитового концентрата
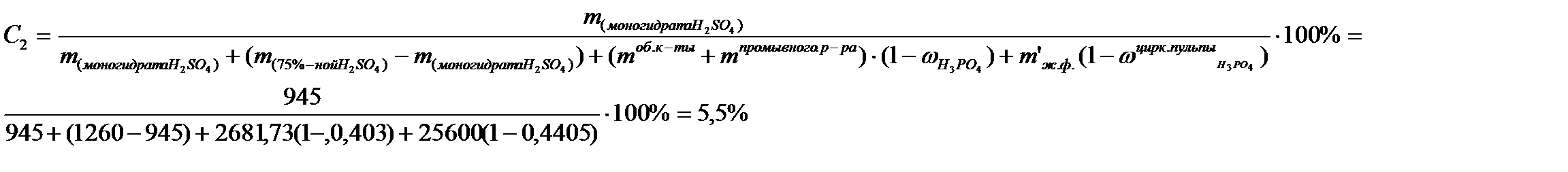
Концентрация Р2О5 в циркулирующей пульпе 31,91 % или 44,05% Н3РО4 т.е. 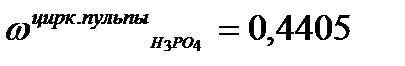
Окончательно:
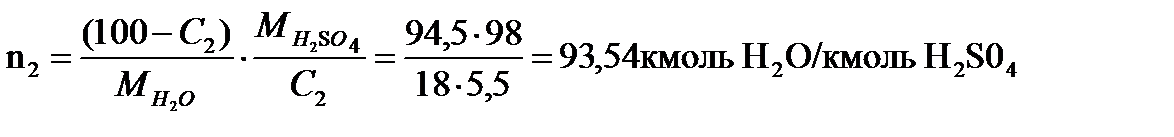
Следовательно:

Поступающий в экстрактор воздух вносит:
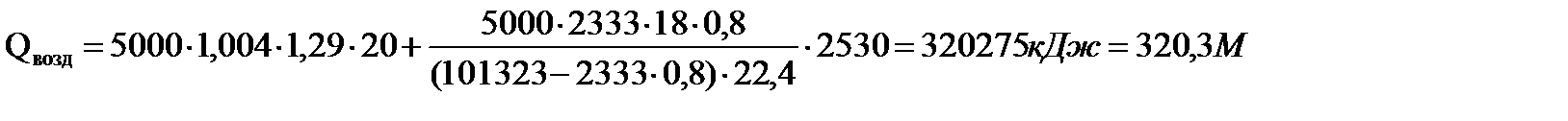 Дж
Дж
(5000 — объем при н. у. поступающего воздуха (по практическим данным), м3/ч;
1,004 — теплоемкость воздуха, кДж/(кг-К);
1,29 — плотность воздуха при 0 °С и 1,013*105 Па (760 мм рт. ст.), кг/м3;
2333 Па — парциальное давление водяных паров в насыщенном при 20° воздухе (17,5 мм рт. ст.);
0,8 — относительная влажность воздуха;
2530 — энтальпия водяных паров при 20 °С, кДж/кг).
Теплота, поступающая в экстрактор с циркулирующей пульпой вакуум-испарителя Qц.п есть разность между общим приходом расходом теплоты.
И окончательно, общий приход теплоты в экстрактор равен:
Qприх=13780,8 + 92370,2 + 434492,1 + 625833,33 + 344764,16 + 320275 + Qц.п =
= 1831215,6 + Qц.п
Расход теплоты
Уносимая теплота есть сумма теплот: пульпы, направляемой на фильтрацию (Qn); газов, выходящих из экстрактора (Qг); циркулирующей пульпы, поступающей из экстрактора в вакуум-испаритель для охлаждения (Q’ц.п) и теплопотерь (Qnoт).
Определяем эти теплоты.
Теплота отходящей от экстрактора пульпы на фильтрацию при 70 °С равна:
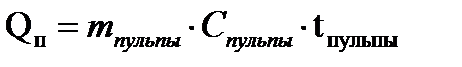
Cпульпы – удельная теплоемкость пульпы, кДж/(кг*К), определяемая по формуле:
Cпульпы = СжХж + СтвХтв
(Сж и С„ — теплоемкости жидкой и твердой фаз в пульпе, кДж/(кг • К); Хж и Хтв — массовые доли жидкой и твердой фаз в пульпе)
Принимаем что жидкая фаза пульпы представляет собой раствор фосфорной кислоты (без учета примесей), а твердая фаза — гипс; тогда:
Сж = ХН2О*СН2О + ХН3РО4 *СН3РО4 = 0,4405*0,483 + 0,6595 *4,1893 = 2,97 кДж/(кг-К),
Cпульпы = 2,97*3200/4800 + 1,072*1600/4800 = 2,337 кДж/(кг*К)
И окончательно:
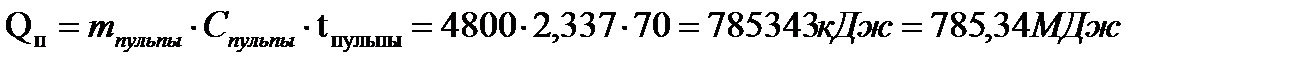
Теплота газов, уходящих из экстрактора при 40°, в расчете на воздух и водяные пары (теплотами HF и SiF4 вследствие малости их пренебрегаем):
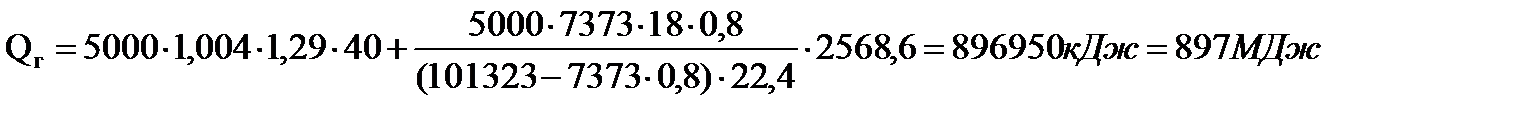
Здесь 5000*1,004*1,29*40 — теплота, уносимая воздухом, поступающим в экстрактор (см. выше); 7373 Па — парциальное давление водяных паров в газе, насыщенном при 40 °С (55,3 мм рт. ст.); 0,8 — относительная влажность воздуха; 2568,6 — теплота водяных паров, кДж/кг.
Теплота, уносимая циркулирующей пульпой, направляемой в вакуум-испаритель, составляет:

Тепло потери Q пот по практическим данным составляют ≈ 2,0 от других статей расхода теплоты, т. е. Q пот = 0,02*(Q’ц..п + Q г + Q п) = 0,02(6281,9 + 897 + 785,34) = 159,3 МДж.
Общий расход теплоты из экстрактора составит:
Qрасх = 785,34 + 897 + 6281,9 + 159,3 = 8123,54 МДж
Зная общий расход, определяем теплоту, вносимую поступающей в экстрактор циркулирующей пульпой; она равна:
Qц. п = 8123,54 – 1831,5 = 6292,04 МДж
Приводим часовой тепловой баланс отделения экстракции фосфорной кислоты:
| Приход | МДж/ч | Расход | МДж/ч |
| с апатитовым концентратом | 13,78 | с пульпой, поступающей на | 785,34 |
| с 75%-ной H2S04 | 92,37 | фильтрование..... | |
| с раствором разбавления.. | 434,5 | с газами, уходящими из | 897,0 |
| теплота реакции разложе- | 625,8 | экстрактора....... | |
| ния апатита...... | с циркулирующей пульпой, | ||
| теплота разбавления | 344,76 | выходящей из экстрак- | |
| 75%-ной H2S04.. •. | тора | 6281,9 | |
| с входящим воздухом... | 320,3 | теплопотери | 159,3 |
| с циркулирующей пульпой | 6292,04 | ||
| Всего | 8123,55 | Всего | 8123,54 |
При рассмотренных условиях и количествах данных веществ тепловой баланс обеспечивает протекание процесса экстракции фосфорной кислоты.
Список литературы
1.Викторов М. М. Методы вычисления физико-химических величин и прикладные расчеты. Л-, «Химия», 1977. 360
2.Здановский А. Б, Галургия. Л-, «Химия», 1972. 527 с..
3.Кафаров В. В.9 Витохих В. Я., Бояриноз Л. Я. Программирование и вычислительные методы в химии и химической технологии. М., «Наука», 1972. 488 с.
4.Копылев Б. А. Технология экстракционной фосфорной кислоты. Л., «Химия», 1972. 311 с.
5.Кочетков В. Н. Технология комплексных удобрений. М., «Химия», 1972. 200 с.
6.Лавров С. С. Введение в программирование. М., «Наука», 1977. 368 с.
7. Ахметов Т.Г., Бусыгин В.М., Гайсин Л.Г. и др. Химическая технология неорганических веществ.— М.: Химия, 1998, 488 с.
8. Ахметов Н.С. Общая и неорганическая химия.— М.: Высшая школа, 2002. 743 с
9. Позин ME. Физико-химические основы неорганической технологии. Д.: Химия, 1985. 384 с.
10. Корбридж Д. Фосфор. Основы химии, биохимии, технологии (1982 г.)
Дата публикования: 2015-10-09; Прочитано: 2005 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
