 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Получения фосфорной кислоты
|
|
Экстракционный метод получения фосфорной кислоты основан на разложении природных фосфатов серной кислотой по реакции
Ca 5 (P04)3F + 5H 2 S0 4 + 5nН20 = 5CaS04*nH20 + ЗН 3 РО 4 + HF
Одновременно происходит разложение и других примесей в исходном фосфатном сырье. К ним относятся: кальцит, доломит, сидерит, глауконит, силикаты железа и алюминия. Они также разлагаются серной кислотой по схеме
CaC0 3 MgC0 3 + 2H 2 S0 4 + (n - 2)Н20 = CaS0 4* nH20 + MgS0 4 + 2COz
K 2 0*Na 2 0*Al 2 0 3 *2Si0 2 + 5H 2 S0 4 = Na 2 S0 4 + K2SO4 + A1 2 (S0 4)3 + 2Si0 2 + 5H20
Диоксид кремния реагирует с HF, образуя SiF4:
Si02 + 4HF = SiF4 + 2Н20
Часть тетрафторида кремния выделяется в газовую фазу, а другая часть образует гексафторкремниевую кислоту, остающуюся в растворе:
SiF4 + 2HF = H2SiF6
Разложение примесей приводит к увеличению расхода серной кислоты, а также снижает степень извлечения P2O5 в целевой продукт вследствие образования нерастворимых фосфатов железа FеНз(Р04)2*2,5Н20 при концентрациях P2O5 выше 40% и FeP04*2H20—при более низких концентрациях. Выделяющийся в процессе разложения карбонатов диоксид углерода образует в экстракторах стойкую пену. Растворимые фосфаты магния, железа и алюминия снижают активность исходной фосфорной кислоты, а также уменьшают содержание усвояемых форм Р20з в удобрениях при последующей переработке фосфорной кислоты.
С учетом влияния примесей фосфаты с повышенным содержанием соединений железа, алюминия, магния и карбонатов непригодны для производства фосфорной кислоты. Поэтому в процессах сернокислотного разложения обычно применяют руды или концентраты, характеризующиеся массовым отношением Fе203:Р205 не более 0,08.
Основой для выбора технологических параметров процессов сернокислотного разложения является выделение сульфата кальция в виде достаточно крупных, легко отделяемых и хорошо отмываемых от фосфорной кислоты кристаллов. В системе CaS04—НзР04—Н20 сульфат кальция может существовать в трех формах: одной безводной (ангидрита CaS04) и двух кристаллогидратов (гемигидрата CaS04*0,5H20 и дигидрата или гипса CaS04*2H20). Температурные и концентрационные области кристаллизации приведенных форм определяются соотношениями их растворимостей в фосфорной кислоте или соотношениями давлений паров над раствором и давлений диссоциации обратимых реакций превращения гипса в гемигидрат или ангидрит и гемигидрата в ангидрит. Из изотерм растворимости сульфата кальция при 80° С (рис. 5) видно, что с увеличением содержания фосфорной кислоты растворимость всех трех модификаций сначала возрастает, достигает максимума при 16—22% Р2О5, а затем уменьшается. Минимальную растворимость при 80° С имеет ангидрит, являющийся равновесной твердой фазой. Мета- стабильный гипс в растворах, содержащих 33,3% Р2О5 (точка А пересечения изотермы метастабильных кристаллогидратов), превращается непосредственно в ангидрит. В более концентрированных растворах сначала происходит конверсия гипса в менее растворимый гемигидрат, после чего последний дегидратируется до ангидрита.
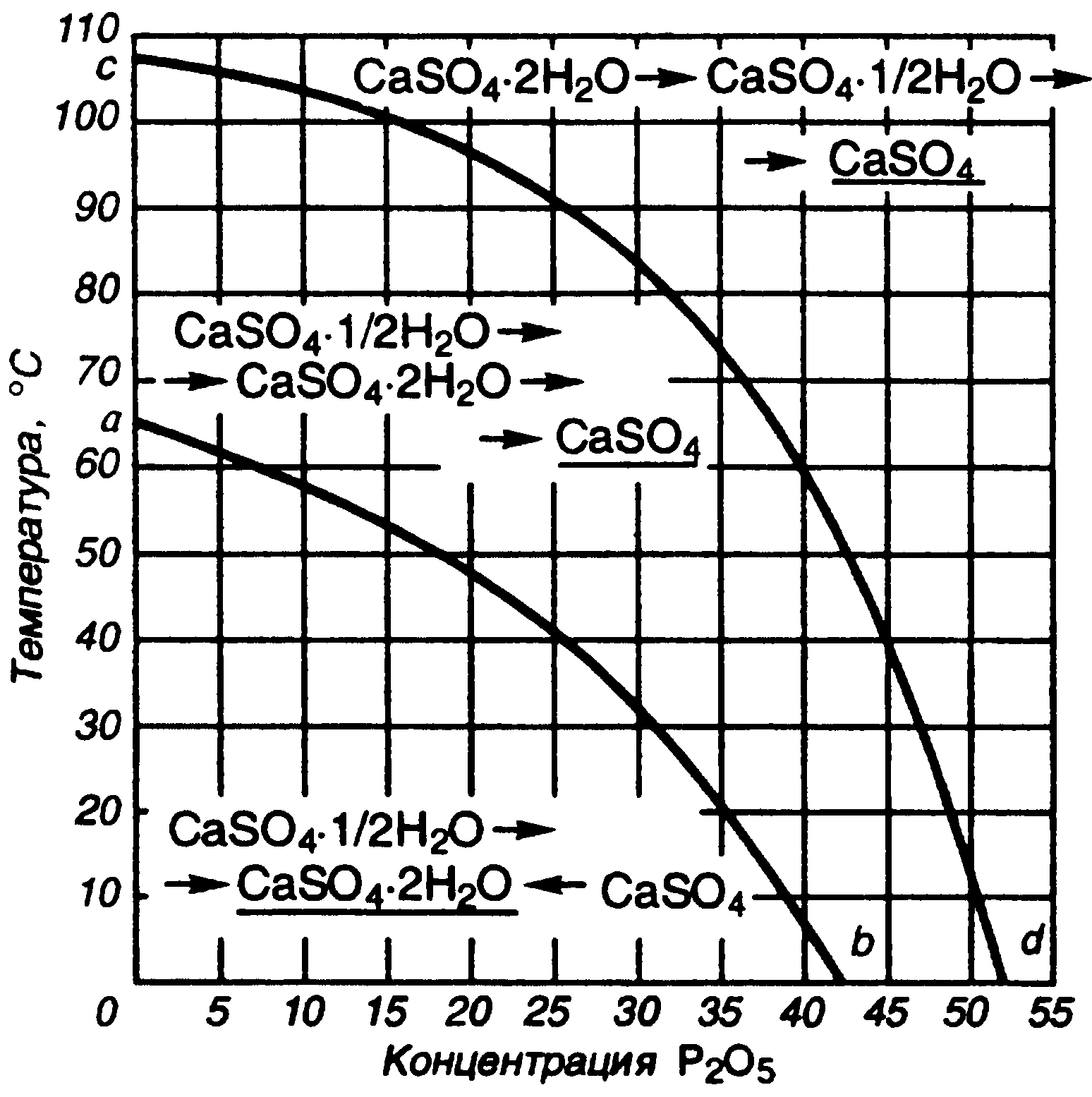
На рис. 6 приведена политермическая диаграмма, характеризующая направление и последовательность фазовых превращений сульфата кальция в системе CaSO4—Н3РО4—Н2О. Стабильными твердыми фазами в системе являются гипс (ниже кривой ab) и ангидрит (выше кривой ab). В области, расположенной над кривой cd, гемигидрат, который большей частью является первой кристаллизующейся фазой системы, переходит в ангидрит.
В области между кривыми cd и аb стабильной формой также является ангидрит, но здесь гемигидрат переходит в ангидрит не непосредственно, а сначала оводняется до гипса. Кривая cd является множеством точек сосуществования этих метастабильных фаз при разных температурах. Аналогично кривая ab является множеством точек сосуществования стабильных гипса и ангидрита. Согласно правилу Оствальда, ниже линии ab стабильная фаза — гипс, и последовательность превращений должна быть такой, как показано на рис.6. На практике образования ангидрита не наблюдается и гемигидрат переходит в гипс. Это объясняется кинетическими причинами, меняющими маршру-ты реакций, например значительно более быстрым превращением ангидрит -> гипс, чем гемигидрат -> ангидрит, в данной области температур и концентраций Р2О5. В других условиях скорость превращения ангидрита может быть меньшей. На скорость и маршрут взаимных переходов могут влиять и ионы примесей.
Следовательно, степень гидратации сульфата кальция, отделяемого в процессе экстракции, может не соответствовать стабильным формам и зависит от конкретных условий осуществления процесса. На рис. 7 приведена диаграмма, показывающая практическую степень гидратации сульфата кальция в зависимости от технологического режима процесса экстракции, и в первую очередь от температуры и концентрации фосфорной кислоты. Как видно из рисунка, в области ниже кривой 2 сульфат кальция отделяется в виде гипса, выше кривой 1 —в виде ангидрита, а между этими линиями — в виде гемигидрата.
В производственных условиях осадок загрязнен примесями Р4О10 в виде неразложенных фосфатов, неотмытой Н3РО4, сокристаллизованных фосфатов различных металлов и др. Поэтому образующиеся сульфаты кальция называют соответственно фосфогипс, фосфогеми- гидрат и фосфоангидрит. В зависимости от типа осаждаемого сульфата различают три способа получения экстракционной фосфорной кислоты: дигидратный, гемигидратный (полугидратный) и ангидритный, а также комбинированные: гемигидратно-дигидратный и дигидратно-гемигидратный. Наиболее распространен на практике дигидратный режим, который осуществляют при 65—80° С, получая при этом кислоту с содержанием до 30—32% Р2О5.


| Рис.5 Изотермы растворимости сульфата кальция в фосфорной кислоте при 80оС. А –ангидрит, П –полугидрат, Г – гипс |
| Рис.7 Влияние температуры и содержания Р2О5 в растворе на прак-тическую гидратированность отде-ляемого осадка сульфата кальция |
| Рис.6 Схема превращений кристаллогидратов сульфата кальция в растворах фосфорной кислоты |
Дата публикования: 2015-10-09; Прочитано: 944 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
