Химическая кинетика – раздел изучающий закономерности протекания химических реакций во времени, зависимости этих закономерностей от внешних условий, а также механизмы химических превращений.
Системы, в которых происходит химическое превращение, могут быть открытыми и замкнутыми. Замкнутой называют систему, в которой отсутствует материальный обмен с окружающей средой. Системы, в которых имеет место материальный обмен с окружающей средой, называются открытыми системами. В таких системах изменение количества вещества может происходить не только в результате химической реакции, но и в результате массообмена.
Реакции делятся на обратимые и необратимые. Необратимые реакции протекают только в одном направлении: от исходных веществ к продуктам, слева направо. Обратимые реакции протекают одновременно как от исходных веществ к продуктам, так и наоборот.
Важным понятием химической кинетики является скорость химической реакции. Эта величина определяет, как изменяется концентрация компонентов реакции с течением времени. Скорость химической реакции — величина всегда положительная, поэтому если она определяется по исходному веществу (концентрация которого убывает в процессе реакции), то полученное значение домножается на −1.
Закон действующих масс, согласно которому скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведённым в некоторые степени.
Скорость химической реакции – это число элементарных актов химического взаимодействия, совершающихся за единицу времени в единице реакционного пространства.
Скоростью химической реакции по некоторому компоненту называют изменение в результате химической реакции количества (объема, массы) этого компонента в единицу времени в единице объема.
Скорость пропорциональна концентрациям реагирующих веществ, поскольку при этом повышается вероятность столкновения молекул реагирующих веществ в единице объема. Если в ходе реакции взаимодействуют два вещества, ключевым называют то одно из исходных веществ, которое находится в недостатке от стехиометрии.
По уравнению (5) парциальное давление вещества в идеальной газовой смеси представляет собой произведение общего давления смеси на мольную долю компонента:
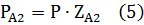
где PA2 –парциальное давление компонента А
P- общее давление газовой смеси
ZA2 - мольная доля вещества А (доли единицы) в конечной смеси
Для простой кинетики общая скорость реакции представляет собой разность скоростей прямой и обратной стадии.
Скорость прямой стадии зависит от произведения константы скорости и парциальных давлений исходных веществ, взятых в степенях, равных соответствующим стехиометрическим коэффициентам исходных веществ.
Скорость обратной реакции – от произведения константы скорости и парциальных давлений конечных веществ, взятых в степенях, равных соответствующим стехиометрическим коэффициентам конечных веществ.
По формулам (6) и (7) можно представить общий вид уравнения Аррениуса:


Где  – предэкспоненциальные сомножители для прямой и обратной реакции;
– предэкспоненциальные сомножители для прямой и обратной реакции;
Е1,Е2 – энергии активации для прямой и обратной реакций дж/моль;
R – универсальная газовая постоянная, равна 8,31 дж/(моль К);
Т – абсолютная температура.
Задача



Вывод:
1. Т. к. реакция экзотермическая ( ), то с увеличением температуры скорость прямой реакции
), то с увеличением температуры скорость прямой реакции 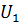 будет меньше зависеть от температуры, чем
будет меньше зависеть от температуры, чем 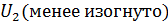 , поэтому скорость суммарной реакции будет иметь максимум в области низких температур. Реакцию следует проводить при низких температурах.
, поэтому скорость суммарной реакции будет иметь максимум в области низких температур. Реакцию следует проводить при низких температурах.
2. Т. к. реакция идет с уменьшением числа молей, то с увеличением давления скорость прямой реакции будет сильнее от него зависеть
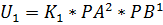 (y=
(y= 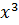 )
)
 (y=
(y= 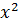 )
)
Поэтому график суммарной скорости реакции будет иметь в области низкого давления минимум, а при увеличении давления возрастать. Реакцию следует проводить при высоком давлении.
3. Т. к. с увеличением степени превращения  , 0,2<0, 4<0,6 скорость суммарной реакции падает, то U(0,2)>U(0,4)>U(0,6).
, 0,2<0, 4<0,6 скорость суммарной реакции падает, то U(0,2)>U(0,4)>U(0,6).

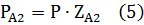


 – предэкспоненциальные сомножители для прямой и обратной реакции;
– предэкспоненциальные сомножители для прямой и обратной реакции;





 ), то с увеличением температуры скорость прямой реакции
), то с увеличением температуры скорость прямой реакции 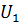 будет меньше зависеть от температуры, чем
будет меньше зависеть от температуры, чем 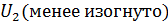 , поэтому скорость суммарной реакции будет иметь максимум в области низких температур. Реакцию следует проводить при низких температурах.
, поэтому скорость суммарной реакции будет иметь максимум в области низких температур. Реакцию следует проводить при низких температурах.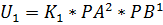 (y=
(y=  )
) (y=
(y=  )
) , 0,2<0, 4<0,6 скорость суммарной реакции падает, то U(0,2)>U(0,4)>U(0,6).
, 0,2<0, 4<0,6 скорость суммарной реакции падает, то U(0,2)>U(0,4)>U(0,6).