 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Программы расчета
|
|
1.Кинетика.
Химическая кинетика - учение о химическом процессе, его механизме и закономерностях развития во времени.
Как известно, системы, в которых происходит химическое превращение, могут быть открытыми или замкнутыми. Замкнутой называют систему, в которой отсутствует материальный обмен с окружающей средой. Важнейшей особенностью замкнутых систем является то обстоятельство, что изменение количества какого-либо химического соединения в таких системах происходит только в результате химического превращения.
Системы, в которых имеет место материальный обмен с окружающей средой, называются открытыми системами. В таких системах изменение количества вещества может происходить не только в результате химической реакции, но и в результате массообмена.
Реакции делятся на обратимые и необратимые. Необратимые реакции протекают только в одном направлении: от исходных веществ к продуктам, слева направо.
Обратимые реакции протекают одновременно как от исходных веществ к продуктам, так и наоборот.
Скоростью химической реакции но некоторому компоненту называют изменение в результате химической реакции количества (объема, массы) этого компонента в единицу времени в единице объема.
Скорость пропорциональна концентрациям реагирующих веществ, поскольку при этом повышается вероятность столкновения молекул реагирующих веществ в единице объема. В процессах, протекающих в газовой фазе, число столкновений молекул и, соответственно, актов химической реакции, возрастает также при увеличении давления, так как при увеличении давления в единице объема увеличивается число молекул, то есть растет, по сути дела, их концентрация.
Если в ходе реакции взаимодействуют два вещества, ключевым называют то одно из исходных веществ, которое находится в недостатке от стехиометрии.
Концентрации реагирующих веществ и скорость химической реакции выражают через степень превращения ключевого вещества.
Скорость газофазных реакций является функцией от летучестей реагирующих веществ. Однако в инженерных расчетах часто оказывается достаточным более грубое приближение идеальных газов, где вместо летучестей фигурируют парциальные давления.
Парциальное давление вещества в идеальной газовой смеси представляет собой произведение общего давления смеси на мольную долю компонента.
В кинетике обратимых газофазных реакций условно можно выделить случай простой кинетики и случай сложной кинетики для реакций, протекающих по многоэтапному механизму.
Прямая и обратная реакция также представляют собой, по сути дела, элементарные стадии обратимого химического процесса. Вклад каждой стадии в общую скорость процесса заранее непредсказуем, так как зависит от многих факторов. Чаще всего это температура, давление смеси, концентрации исходных веществ и степень превращения.
Значительно проще дело обстоит для случая простой кинетики, хотя в производстве простая кинетика встречается довольно редко.
Для простой кинетики общая скорость реакции представляет собой разность скоростей прямой и обратной стадий.
Скорость прямой стадии зависит от произведения константы скорости и парциальных давлений исходных веществ, взятых в степенях, равных соответствующим стехиометрическим коэффициентам исходных веществ.
Скорость обратной реакции - от произведения константы скорости и парциальных давлений конечных веществ, взятых в степенях, равных соответствующим стехиометрическим коэффициентам конечных веществ.
Степень, в которую возводят парциальные давления (или концентрации), называют порядкам реакции по данному веществу.
Сумма показателей степеней, в которые возведены парциальные давления, называется порядком реакции.
| T | U | P | X |
| 1,68E+000 | 0,5 | ||
| 2,18E+000 | 0,5 | ||
| 2,78E+000 | 0,5 | ||
| 3,50E+000 | 0,5 | ||
| 4,34E+000 | 0,5 | ||
| 5,32E+000 | 0,5 | ||
| 6,44E+000 | 0,5 | ||
| 7,71E+000 | 0,5 | ||
| 9,15E+000 | 0,5 | ||
| 1,08E+001 | 0,5 |
| T | U | P | X |
| 9,09E-001 | 0,7 | ||
| 1,18E+000 | 0,7 | ||
| 1,51E+000 | 0,7 | ||
| 1,90E+000 | 0,7 | ||
| 2,35E+000 | 0,7 | ||
| 2,88E+000 | 0,7 | ||
| 3,49E+000 | 0,7 | ||
| 4,18E+000 | 0,7 | ||
| 4,96E+000 | 0,7 | ||
| 5,83E+000 | 0,7 |
| T | U | P | X |
| 2,72E-001 | 0,9 | ||
| 3,53E-001 | 0,9 | ||
| 4,51E-001 | 0,9 | ||
| 5,67E-001 | 0,9 | ||
| 7,04E-001 | 0,9 | ||
| 8,62E-001 | 0,9 | ||
| 1,04E+000 | 0,9 | ||
| 1,25E+000 | 0,9 | ||
| 1,48E+000 | 0,9 | ||
| 1,74E+000 | 0,9 |
2. Расчет реактора полного смешения.
Обратная задача.
Расчет фактической степени превращения, которая достигается в реакторе заданного объема, при давлении 5 атмосфер и различных температурах входа.
Объем реактора можно рассчитать, зная время пребывания газовой смеси по уравнению:

где τn – время пребывания реакционной смеси внутри реактора, ед. врем;
Vp – объем реактора, м3;
V – объемный расход смеси через реактор при нормальных условиях, м3/с.
Время превращения в проточном реакторе полного смешения (РПС) рассчитывается по формуле:
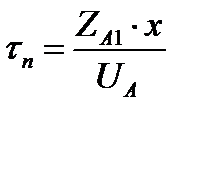
где τn – время пребывания реакционной смеси внутри реактора, ед. врем;
ZA1 – концентрация ключевого вещества на входе в реактор, мольная доля;
x – конечная степень превращения вещества А на выходе реактора, доли единицы;
UA – скорость химической реакции по веществу А, как функции от конечной степени превращения, м3 вещ.А/м3∙с;
Знание объема реактора по заданному объемному расходу смеси и времени пребывания газовой смеси внутри реактора позволяет рассчитать фактическую степень превращения.
Уравнение обычно называют уравнением материального баланса. Иногда в литературе это уравнение называют характеристическим.
Температура выхода из реактора вычисляется по формуле:
Т = Твх±  ·Х – уравнение адиабаты
·Х – уравнение адиабаты
(знак зависит от вида реакции, в случае эндотермической реакции”-“, экзотермической ”+”)

|
Коэффициент адиабатического разогрева
СР - мольная теплоемкость
Н – теплота образования 1 моля продукта
Cp=ZA1·Cp+ZB1 ·Cp+ ZC1·Cp+ ZD1·Cp+ ZI1·Cp=41,1447 Дж/(моль·К)
Н298= 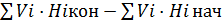
H298= 164960 Дж
Ср298-Т= 
Ср298-Т=32,31 Дж/(моль·К)
Нт=Н298+Ср298-Т(Т - 298)
НТ=194103,62 Дж
= 0,2·194103,62÷41,1447=943, 52
| T0 | T | X | U |
| 1305,1 | 0,05 | 1,08E+000 | |
| 1346,22 | 0,06 | 1,44E+000 | |
| 1382,07 | 0,07 | 1,85E+000 | |
| 1413,93 | 0,09 | 2,28E+000 | |
| 1445,6 | 0,11 | 2,77E+000 | |
| 1475,82 | 0,13 | 3,28E+000 | |
| 1505,1 | 0,15 | 3,81E+000 | |
| 1534,73 | 0,18 | 4,38E+000 | |
| 1561,69 | 0,2 | 4,90E+000 | |
| 1592,43 | 0,22 | 5,55E+000 |
3.Материальный баланс химического реактора.
Необходим при проектировании и его проверке. Рассчитывается на ед. времени или на ед. продукции.
Играет важную роль в экономических подсчетах.
Рассмотрим материальный баланс проточного газофазного реактора.
Количество вещества определяется совокупностью структурных элементов (атомов молекул, ионов и т.п.). Количество вещества измеряют в молях.
Дата публикования: 2015-10-09; Прочитано: 252 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
