 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
S о K n § о
|
|
a i?; s f *
G s g
P rt d) о и К Ч Ч я а и S
| Ss |
{Tj Д QJ
S 5S.й.л
А н
О К
Си s
S м4
Со ь-1
S н
S О О
G «m JS О М
О о Я
 146 Глава 4. Эволюционная концепция
146 Глава 4. Эволюционная концепция
 рой же закон термодинамики можно сформулировать как утвержде-
рой же закон термодинамики можно сформулировать как утвержде-
ние о невозможности сохранения определенной физической величи-
ны (п. 2.2.3).
Во-вторых, известно много формулировок второго закона. Они! полностью эквивалентны в смысле формальной логики, т. е. любая; из них влечет за собой все остальные формулировки как следствия.; Однако каждая раскрывает действие закона со своей, подчас доволь-; но неожиданной и глубокой точки зрения. Мы рассмотрим несколь-ко важнейших формулировок второго закона термодинамики, опуская доказательства их эквивалентности. Вот наиболее общая из них. Г Существует физическая величина — энтропия, которая в замкнутой системе с течением времени может только возрастать.
Этого утверждения, ничего пока не говорящего о том, что такое энтропия, уже достаточно, чтобы признать прошлое и будущее физически различными. Поэтому второй закон термодинамики можно рассматривать как физическое утверждение о направленности времени.
Понятие энтропии, как и неразрывно связанное с ним второе начало термодинамики, имеет чрезвычайно много граней и смыслов.
4.4.1. Энтропия как измеряемая физическая величина
Энтропия не есть некое расплывчатое общефилософское понятие типа «идея», «стремление» и т. п. Нет, это нормальная физическая величина, поддающаяся точному измерению и вычислению. Р. Клау-зиус, который ввел понятие энтропии, определил ее следующим образом. Пусть некоторому телу сообщили количество теплоты Q при температуре Т (отсчитываемой от абсолютного нуля). Тогда энтропия тела 5 возрастет минимум на
Т
Отношение Q/T несложно измерить. Приборы для измерения количества теплоты, калориметры, не были новинкой и во времена Клаузиуса; приборы для измерения температуры окружают сейчас каждого из нас в быту.
4.4.2. Энтропия как мера некачественности энергии
Первый закон термодинамики — закон сохранения энергии — можно сравнить с добросовестным бухгалтером, который сводит количест-
4.4. Второй закон термодинамики. Энтропия 147
 венный баланс, не вмешиваясь в решения, принимаемые хозяином фирмы и не оценивая их с точки зрения, так сказать, качества капитала. Однако каждый понимает, что обменять деньги на эквивалентное количество, скажем, старых калош, довольно легко, а вот обратная операция потребует усилий и вряд ли обойдется без финансовых потерь. Несмотря на то что стоимость калош может быть эквивалентна потраченной сумме, такой качественный показатель, как ликвидность, у них гораздо ниже, чем у денег.
венный баланс, не вмешиваясь в решения, принимаемые хозяином фирмы и не оценивая их с точки зрения, так сказать, качества капитала. Однако каждый понимает, что обменять деньги на эквивалентное количество, скажем, старых калош, довольно легко, а вот обратная операция потребует усилий и вряд ли обойдется без финансовых потерь. Несмотря на то что стоимость калош может быть эквивалентна потраченной сумме, такой качественный показатель, как ликвидность, у них гораздо ниже, чем у денег.
♦ Разные формы энергии также обладают разным качеством.
 О качестве энергии легче всего судить по легкости ее превращения в другие формы.
О качестве энергии легче всего судить по легкости ее превращения в другие формы.
Не представляет проблемы, например, превращение энергии электрического тока в равное количество тепловой энергии. Для этого достаточно взять утюг или кипятильник и воткнуть вилку в розетку. Превращение электрической энергии в тепловую пойдет со стопроцентной эффективностью. Обратная же задача — превратить тепловую энергию в электрическую — гораздо сложнее. Для ее решения необходимо построить сложную и дорогостоящую тепловую электростанцию. На электростанции теплота, выделяющаяся при сжигании топлива, идет на нагревание воды, которая превращается в пар, который крутит турбину, которая вращает ротор генератора, который, наконец, вырабатывает электрический ток. В итоге же оказывается, что даже самая лучшая тепловая электростанция превращает в электроэнергию не больше 40% тепловой энергии сгорания топлива. И дело тут не в нерадивости инженеров, проектировавших и строивших станцию, а в том, что сама природа не позволяет добиться большего. Просто тепловая энергия — это энергия менее качественная, менее «ликвидная», чем электрическая.
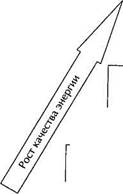
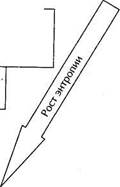
Можно выстроить иерархию различных форм энергии по ее качеству. На верхних ступенях, кроме электрической, находится, например, механическая энергия. Именно благодаря этому КПД гидроэлектростанций, которые используют механическую энергию падающей воды, гораздо выше, чем у тепловых — до 98%. Чуть ниже по качеству химическая энергия, заключенная, например, в бензине или в аккумуляторах. Самым низким качеством обладает энергия тепловая, причем качество ее тем ниже, чем ниже температура тела.
Открытие энтропии дало возможность от общих рассуждений о качестве энергии перейти к его точной количественной характеристике. Установлено, что если система обладает запасом энергии U,
|
|
| 148. Глава 4. Эволюционная концепция |
| Механическая, электрическая, ядерная (с оговорками) |
| Химическая |
| Тепловая (высокие температуры) |
| Тепловая (низкие температуры); |
• Рис. 4.6. Иерархия форм энергии по признаку качества
т,о в полезную работу можно превратить не весь этот запас, а лишь его часть, которая называется свободной энергией:
F=U-TS.
Свободную энергию Fvi следует считать мерой качества энергети- | ческого запаса системы. Видно, что она тем меньше, чем больше энтропия S. Поэтому
энтропия системы является мерой некачественности ее энергети
ческого запаса. (
С учетом этого закон возрастания энтропии можно сформулировать так:
| Г |
энергетический запас замкнутой системы, оставаясь неизменным количественно, с течением времени неуклонно ухудшается качественно.
Энергетические проблемы цивилизации заключаются не в том, чтобы найти источник энергии для удовлетворения потребностей человека, а том, чтобы найти источник энергии высококачественной. Будь иначе, мы могли бы буквально черпать энергию из океана. Действительно, в океанах Земли находится 1,3 • 1021 литра воды. При охлаждении каждого литра воды на один градус он отдает 4200 Дж теплоты. Это означает, что если бы можно было тепловую энергию полностью превратить в электрическую, то достаточно было бы ежегодно охлаждать океан всего лишь на 0,0002 °С, чтобы полностью покрыть все современные энергетические потребности человечества, составляющие около 1021 Дж в год. Идея кажется тем более заман-
4.4. Второй закон термодинамики. Энтропия 149
 чивой, что практически вся производимая электроэнергия в конечном счете превращается в тепло, нагревающее тот же океан. Она, однако, неосуществима: запасы энергии океана действительно огромны, но его свободная энергия, которую можно превратить не в тепло, а в полезную работу, очень низка из-за высокой энтропии, Поэтому строительство сложных, дорогих и экологически грязных электростанций оказывается в итоге гораздо выгоднее.
чивой, что практически вся производимая электроэнергия в конечном счете превращается в тепло, нагревающее тот же океан. Она, однако, неосуществима: запасы энергии океана действительно огромны, но его свободная энергия, которую можно превратить не в тепло, а в полезную работу, очень низка из-за высокой энтропии, Поэтому строительство сложных, дорогих и экологически грязных электростанций оказывается в итоге гораздо выгоднее.
4.4.3. Вероятностный смысл энтропии
Глубокое понимание сущности энтропии невозможно без выяснения того, что же она представляет собой с точки зрения движения и взаимодействия молекул. Главный результат исследования этого вопроса Л. Больцманом заключается в короткой формуле, которую он завещал выбить на своем надгробии. В современных обозначениях она записывается следующим образом:
S = k\nW,
где S — энтропия системы молекул, k — коэффициент пропорциональности (постоянная Больцмана), W— статистический вес данного макроскопического состояния системы. Чем больше W, тем больше inW и тем больше энтропия 5.
| Г |
Статистический вес — это число способов, которым можно реализовать данное макроскопическое состояние системы.
Пояснить определение статистического веса можно на примере ящика с двумя одинаковыми отделениями, между которыми имеется перегородка с небольшим отверстием. Начнем заполнять ящик молекулами. Для определенности будем считать, что всего в нашем распоряжении N = 10 молекул.

|
| Рис. 4.7. Простая модель молекулярной системы |
Макроскопическое состояние системы задается числом молекул в каждом отделении. Например, состояние системы на рис. 4.7 может быть обозначено как состояние 4|6.

 150 Глава 4. Эволюционная концепция
150 Глава 4. Эволюционная концепция

 Способы, «которыми можно реализовать данное состояние систе| мы», отличаются друг от друга тем, какие именно молекулы попали левое отделение. Представим, что все 10 молекул пронумерованы! Состояние 4|6 можно получить, поместив в левое отделение молекуЦ лы номер 1, 2, 3 и 4. А можно — 1, 3, 5, 7 или 7, 8, 9 и 10.
Способы, «которыми можно реализовать данное состояние систе| мы», отличаются друг от друга тем, какие именно молекулы попали левое отделение. Представим, что все 10 молекул пронумерованы! Состояние 4|6 можно получить, поместив в левое отделение молекуЦ лы номер 1, 2, 3 и 4. А можно — 1, 3, 5, 7 или 7, 8, 9 и 10.
Наименьший статистический вес W — 1 имеют состояния 0| 10 *~ 10|0, поскольку есть лишь один способ поместить все молекулы т правое (левое) отделения. Статистический вес состояния 1|9 равен 10-| (поскольку одну молекулу, помещаемую в левое отделение, можно! выбрать из всех имеющихся десятью способами). Если рассмотреть! состояние с двумя молекулами в левом отсеке, то первую из них мы, можем выбрать опять десятью способами, а вторую — девятью (одну, из 9 оставшихся). Всего вариантов выбора получается 10 • 9 = 90, но' это число надо разделить пополам во избежание двойного счета. Дей-' ствительно, если мы выбираем для левого отделения сначала молекулу № 5, а затем — № 3, то это тот же способ размещения, что дает выбор сначала третьей, а потом уж пятой молекулы. Таким образом, статистический вес состояния 2|8 (и состояния 8|2) равен 45. Нетруд-1 но догадаться, что максимальным статистическим весом обладает состояние, в котором молекул в отделениях поровну (рис. 4.8).
25СН
50Ч
123456789 Количество молекул в левом отделении
Рис. 4.8. Статистические веса состояний системы, изображенной на рис. 4.7
Поместим все десять молекул в левое отделение и закроем ящик. Молекулы беспорядочно двигаются, сталкиваются друг с другом и со стенками, время от времени проскакивая через отверстие из одного
4.4. Второй закон термодинамики. Энтропия 151
 отделения в другое. Можно ли ожидать, что, открыв через некоторое время ящик, мы опять обнаружим все десять молекул в одном отделении? Здравый смысл и интуиция подсказывают, что скорее всего мы увидим состояние 5|5. Физик вместо «скорее всего» предпочтет сказать: «Вероятность состояния 5|5 больше, чем вероятность состояния 0|10», поскольку вероятность есть величина, выражаемая числом. Но наиболее вероятное состояние 5|5 — это состояние с наибольшим статистическим весом, а значит, и энтропией. Таким образом, чем больше вероятность состояния, в котором находится система, тем больше ее энтропия.
отделения в другое. Можно ли ожидать, что, открыв через некоторое время ящик, мы опять обнаружим все десять молекул в одном отделении? Здравый смысл и интуиция подсказывают, что скорее всего мы увидим состояние 5|5. Физик вместо «скорее всего» предпочтет сказать: «Вероятность состояния 5|5 больше, чем вероятность состояния 0|10», поскольку вероятность есть величина, выражаемая числом. Но наиболее вероятное состояние 5|5 — это состояние с наибольшим статистическим весом, а значит, и энтропией. Таким образом, чем больше вероятность состояния, в котором находится система, тем больше ее энтропия.
 ♦ Энтропия является мерой вероятности обнаружить систему в данном состоянии.
♦ Энтропия является мерой вероятности обнаружить систему в данном состоянии.
 Отсюда еще одна формулировка закона возрастания энтропии:
Отсюда еще одна формулировка закона возрастания энтропии:
| Г |
С течением времени замкнутая система самопроизвольно переходит из менее вероятных в более вероятные состояния. Выясненный вероятностный характер понятия энтропии обусловливает и вероятностный, статистический характер второго закона термодинамики. Конечно, состояние 5|5 более вероятно, чем состояние 0|10, но это не означает, что последнее невозможно. Есть примерно один шанс из тысячи, что, заглянув в очередной раз в ящик, мы обнаружим, что все молекулы опять собрались в правом отделении. Физик скажет, что возникла флуктуация (с. 112). Поэтому последнюю формулировку второго закона следует понимать как утверждение о наиболее вероятном, но не единственно возможном развитии событий, как утверждение об общей тенденции. Правда, чем больше число молекул в системе, тем жестче выдерживается эта тенденция. Общее правило гласит, что в системе Л^частиц реально можно наблюдать флуктуации относительной величины примерно у^. В макро-скопических системах, для которых N~ 1024 и у^~ 10~12, сколько-нибудь значительные отклонения от среднего не наблюдаются никогда.
4.4.4. Энтропия как мера неупорядоченности
Какое из состояний рассмотренной нами простейшей системы, состоящей из ящика с двумя отделениями и десяти молекул в нем, можно назвать более упорядоченным: однородное состояние 5|5 или предельно неоднородное 0|10?
Обычно мнения по заданному вопросу разделяются почти пополам. Многими упорядоченность понимается в духе армейского еди-
152 Глава 4. Эволюционная концепция
4.4. Второй закон термодинамики. Энтропия 153


 нообразия: порядок тогда, когда все одинаково одеты и одинаковё! застилают койки. Однако армия, в которой нет разных родов войск! нет командиров и подчиненных, нет никакой неоднородности — это! не армия, не организация, а толпа, пусть даже вся она облачена в ка-| муфляж.
нообразия: порядок тогда, когда все одинаково одеты и одинаковё! застилают койки. Однако армия, в которой нет разных родов войск! нет командиров и подчиненных, нет никакой неоднородности — это! не армия, не организация, а толпа, пусть даже вся она облачена в ка-| муфляж.
Понятие упорядоченности тесно связано с понятием структуры, \ а структура требует неоднородности. Английский парк более упоря-] дочен, чем естественная роща тех же размеров, поскольку имеет бо- j лее четко выраженную структуру: дорожки, кусты, деревья. При этом \ растения каждого вида высаживаются только на определенных уча- i стках, а в других местах парка вы их не найдете. В библиотеке поря- ] док, если книги по полкам распределены неоднородно: на этой пол- ■ ке — только книги по истории, а на той — только по химии и т. д.-! Более однородное состояние является менее упорядоченным. Но эн- ■ тропия системы максимальна именно для ее однородного состояния. Таким образом, мы приходим к пониманию еще одного свойства энтропии:
 ♦ Энтропия системы есть мера неупорядоченности состояния, в котором находится система.
♦ Энтропия системы есть мера неупорядоченности состояния, в котором находится система.
 Связанная формулировка второго закона термодинамики гласит:
Связанная формулировка второго закона термодинамики гласит:
| Г |
С течением времени степень упорядоченности замкнутой системы неизбежно понижается, а имеющиеся в ней структуры разрушаются.
4.4.5. Энтропия и информация
Обратимся еще раз к модели ящика с двумя отделениями: в каком случае мы знаем о системе больше — когда она находится в состоянии 0|10 или 5|5? Очевидно, в первом: про каждую молекулу мы можем точно сказать, в каком она отделении — в правом. Если же система находится в состоянии 5|5, то интересующая нас конкретная молекула может с равной вероятностью быть в любом отделении.
Для остальных состояний количество доступной информации о системе будет промежуточным между этими двумя крайними случаями. Например, если нам известно, что состояние системы есть 8|2, то на вопрос «где находится молекула №1?» можно ответить, что с вероятностью 0,8 она в левом отделении, а это означает, что мы знаем больше, чем ничего. Прослеживается четкая связь: чем меньше статистический вес состояния системы, т. е. чем меньше энтропия, тем определеннее наши знания о системе.
♦ Энтропия системы есть мера отсутствия информации о ее внутреннем устройстве.
 Поэтому в силу закона возрастания энтропии количество доступной информации о замкнутой системе с течением времени уменьшается.
Поэтому в силу закона возрастания энтропии количество доступной информации о замкнутой системе с течением времени уменьшается.
Одна из основных дисциплин, определяющих лицо современной науки и.технологии, — это теория информации. Ее основой стали работы К. Шеннона, опубликованные в 1948-1949 гг., где он дал четкое определение понятия о «количестве информации».
Исходным для Шеннона было понятие энтропии распределения вероятностей некоторых событий. Под событием можно понимать, например, появление определенной буквы в тексте, передаваемом по каналу связи. До того как приемник получил значение очередной буквы, на ее месте можно было ожидать появление почти любого символа алфавита. Другими словами, распределение вероятностей событий «на данном месте стоит п-я буква алфавита» было более или менее однородным. Получение, скажем, буквы «А», вносит неоднородность: вероятность того, что на данном месте стоит «А», становится равной единице, а вероятности любых других символов — нулю. Но увеличение неоднородности приводит, как мы уже знаем, к уменьшению энтропии!
Шеннон определил количество полученной системой информации А/ как понижение ее энтропии в результате приема сообщения:
М = -AS.
Это определение, основанное на понимании энтропии как меры отсутствия информации, оказалось чрезвычайно плодотворным и представляет собой теоретическую основу всех современных технологий передачи, хранения и обработки информации.
4.4.6. Энтропийный анализ текстов
Понимание энтропии как меры неупорядоченности системы позволяет применять ее для описания свойств не только материальных объектов, но и сообщений.
Представим себе, что у нас есть отрывок текста, написанного буквами русского алфавита, причем слова отделяются только пробелами, знаков препинания нет. Вместо букв с тем же успехом можно было бы использовать числа от 1 до 34 (№ 34 означает пробел). Физической моделью такого текста служит ящик с количеством отделений, равным количеству букв в тексте, причем количество молекул в каж-
154 Глава 4. Эволюционная концепция
4.5. Основной парадокс эволюционной картины мира 155

 дом отделении соответствует номеру буквы в алфавите. Можно onpd делить понятие статистического веса и для такой системы и вычис лить его с помощью приемов, подобных тем, что описаны в п. 4.Л.1 Формула Больцмана говорит, что энтропия этой системы максу малыга, если вероятность обнаружить в заданном отделении./V моле кул (вероятность того, что заданная буква текста имеет номер N в ал! фавите) одна и та же для любого iV (на заданном месте может с равной вероятностью стоять любая буква или пробел). Состоянием с наи! большей энтропией (примерно 3,5& на одну букву), как и положенс оказывается наиболее однородное состояние. Однако оно соответст$ вует и наиболее бессмысленному тексту! Вот классический пример текста, в котором вероятность появления (другими словами, распроЗ страненность) любой буквы одна и та же1:
дом отделении соответствует номеру буквы в алфавите. Можно onpd делить понятие статистического веса и для такой системы и вычис лить его с помощью приемов, подобных тем, что описаны в п. 4.Л.1 Формула Больцмана говорит, что энтропия этой системы максу малыга, если вероятность обнаружить в заданном отделении./V моле кул (вероятность того, что заданная буква текста имеет номер N в ал! фавите) одна и та же для любого iV (на заданном месте может с равной вероятностью стоять любая буква или пробел). Состоянием с наи! большей энтропией (примерно 3,5& на одну букву), как и положенс оказывается наиболее однородное состояние. Однако оно соответст$ вует и наиболее бессмысленному тексту! Вот классический пример текста, в котором вероятность появления (другими словами, распроЗ страненность) любой буквы одна и та же1:
СУХЕРРОБЬДЩ ЯЫХВЩИЮАЙЖТЛФВН ЗАГФОЕНВШТЦРПХГБКУЧТЖЮРЯП...
Понять, что приведенная фраза бессмысленна, может и человека не знающий русского. Во-первых, в естественном языке слова не тщ кие длинные, т. е. пробел должен встречаться гораздо чаще. Во-вторых, в каждом языке есть буквы, употребляемые чаще других (на-! пример, в русском это «о», в английском — «е»). В-третьих, веро^ ятность того, что на данном месте стоит данная буква, во многом] зависит от ее окружения: после пробела мы никогда не увидим твер* дого или мягкого знака, а после букв «тьс» наверняка идет «я». Таким| образом, осмысленный, упорядоченный текст не может рассматри-; ваться как однородная система. Именно благодаря свойству неодно7| родности осмысленного текста разгадывают зашифрованные посла:! ния герои рассказов А. К. Дойля «Пляшущие человечки» и Э. По| «Золотой жук».
Расчет, учитывающий неоднородность текста на естественнее языке, показывает, что его энтропия составляет примерно 0,7£ на букву, т. е. в пять раз меньше, чем у беспорядочного набора букв. Этот! результат практически не зависит от того, какой именно язык мы выбрали для анализа. Снова мы убеждаемся, что снижение энтропи: эквивалентно повышению упорядоченности.
В 1994 г. группа ученых, возглавляемая известным специалистом^ по статистической физике Ю. Стэнли, рассчитала энтропию генетического текста в некодирующих участках ДНК (п. 4.3.3.4) и обнару-1
 1 Седов Е. Одна формула и весь мир. Книга об энтропии. М.: Знание, 1982.
1 Седов Е. Одна формула и весь мир. Книга об энтропии. М.: Знание, 1982.
жила, что она существенно ниже, чем для чисто случайной последовательности нуклеотидов1. Более того, она оказалась ниже, чем энтропия кодирующих последовательностей! Это заставило предположить, что и молчащие участки несут какой-то смысл. Прошедшие с тех пор 10 лет полностью подтвердили это предположение (п. 4.3.3.4).
Дата публикования: 2015-10-09; Прочитано: 392 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
