 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Гетерогенных реакций
|
|
3.1. Цель работы.
Определение энергии активации окисления металла кислородом воздуха методом интерференционной индикации
При экспонировании металла в газовой атмосфере, содержащей кислород или другие окислительные газы (Н20 и СО2 и т.п,), его поверхность покрывается слоем окислов (в металлургии используется термин "'окалина°) толщина которого увеличивается со временем. При высоких температурах этот процесс, называемый высокотемпературной коррозией, развивается с заметной скоростью и приводит к потерям металла при его нагреве перед прокаткой, ковкой, штамповкой и другими видами металлообработки. Поэтому изучение кинетических закономерностей высокотемпературного окисления металлов и сплавов и, в частности определение энергии активации данного процесса, имеют высокое значение для разработки мер, уменьшающих коррозионные потери металлов, а также для поиска новых жаростойких материалов.
Нагрев металла в окислительной атмосфере сопровождается его окислением по реакции общего вида
2Ме + O2↔ 2МеО. (3.1)
Реакция идет в прямом направлении этом случае, если давление кислорода в газовой фазе больше давления (упругости) диссоциации оксида. Поскольку большинство металлов образует термодинамически прочные оксиды и значения давлений диссоциации одень малы, то их окисление возможно даже в газовой фазе, содержащей небольшие количества кислорода, и тем более в атмосфере воздуха.
Окисление металлов является типичным гетерогенным процессом, которые протекают в системах, состоящих из различных по физическим свойствам, или химическому составу фаз и отделенных друг от друга поверхностями раздела. Отличительной особенностью таких процессов является многостадийность. Процесс образования окалины состоит из ряда последовательных стадий:
а) Транспорт (диффузия или принудительная конвекция) окислительного газа к поверхности окисла;
б) внутренняя диффузия в слое окалины,
в) кристаллическое превращение на границе раздела фаз.
Окалина находится между двумя средами (фазами) между металлом и газом (рис.3.1). В пределах этого слоя концентрация кислорода падает от границы раздела газ/Ме0 к границе МеО/Ме, а концентрация металла уменьшается в противоположном направлении. Это создает предпосылки к диффузии веществ в слое окисла.
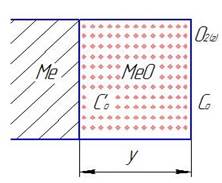
Рис. 3.1. Схема процесса окисления твердого металла (Со>С1)
Коэффициент диффузии в твердой окалине зависит от ее макроструктуры, определяемой соотношением мольных объемов окисла (Vok) и металла (VMе). Если VMе > Vok, то образующийся слой окисла пористый и через него. окислительный газ сравнительно легко проникает к металлу.
Такими свойствами обладают, например, системы К/К20 (α = VMе / Vok = 2,44), Nа/Nа2O (α = 1,76), Са/СаО (α: = 1,56), Мg/Mg0 (α = 1,27).
Напротив, при VMе < Vок окалина покрывает металл сплошным покровом, создающим значительное диффузионное сопротивление и затрудняющим окисление. К данной второй группе относятся А1/А1203 (α = 0,805), Ni/NiO (α = 0,625), Сα/Сu2О (а = 0,585), Сг/Cr2O3 (α = 0.492), Fe/Fe7O3 (α = 0.464).
Полагая, что транспорт окислителя из газовой среды к границе газ/МеО протекает сравнительно быстро и процесс контролируется стадиями б) и в), а также, в слое МеО диффундирует только кислород. Выведем уравнение зависимости толщины слоя окалины от времени окисления t при постоянной температуре.
Выразим наблюдаемую скорость процесса через приращение толщины слоя окалины в единицу времени:
Vq = dy/dt (3.2)
В соответствии с законом Фика скорость внутренней диффузии в слое
Vq =  (C0 - C'0) (3.3)
(C0 - C'0) (3.3)
где D - коэффициент диффузии; 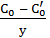 - градиент у концентрации кислорода в окисном слое; Со и С'о - концентрация кислорода в газе и на границе раздела МеО/Ме (рис.3.1).
- градиент у концентрации кислорода в окисном слое; Со и С'о - концентрация кислорода в газе и на границе раздела МеО/Ме (рис.3.1).
Если допустить, что реакция ка поверхности Ме/МеО имеет первый порядок, то ее скорость
Vк = К· С'о (3.4)
где К — константа скорости.
При установившемся режиме скорости последовательных стадий и общая скорость равны между собой:
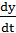 = Vq = Vk, (3.5)
= Vq = Vk, (3.5)
или
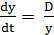 (C0 - C'0) и
(C0 - C'0) и 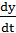 = K C'0 (3.6)
= K C'0 (3.6)
Исключив из этик уравнений не подающуюся непосредственному определению промежуточную концентрацию C'0 получим
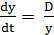 (C0 -
(C0 - 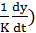 . (3.7)
. (3.7)
Разделив переменные, найдем
ydy +  dy = DC0dt. (3.8)
dy = DC0dt. (3.8)
В начальный момент процесса (t = 0) окалины еще нет, и у = 0.
Интегрирование от этих граничных условий дает
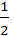 у +
у +  у = DCot. (3.9)
у = DCot. (3.9)
Для металлов первой группы, с пористым строением окалины, D» К. При не слишком больной ее толщине (у) можно пренебречь первым слагаемым в сравнении со вторым в уравнении (3.9), которое превращается в
 у ≈ DCot или у = КС0t (3.10)
у ≈ DCot или у = КС0t (3.10)
Отсюда следует:
a) толщина слоя окалины прямо пропорциональна времени (t) то есть окисление идет с постоянной скоростью;
б) скорость окисления определяется особенностями кристаллохимической стадии, то есть процесс находится в кинетической области.
Для металлов второй группы, имеющих сплошной слой окалины, коэффициент диффузии D гораздо меньше, чем в предыдущем случае, и он обычно меньше константы скорости К. В начале процесса, когда толщина окисной пленки еще мала, у2 «у, здесь также можно пренебречь первым слагаемым и получить то же уравнение (3.10) и те же выводы из него.
При значительной толщине слоя у2 » у. Пренебрегая вторым слагаемым в уравнении (3.9), получаем
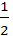 у2 = DCot или
у2 = DCot или  , (3.11)
, (3.11)
откуда:
а)толщина окалины пропорциональна 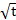 , то есть скорость со временем уменьшается;
, то есть скорость со временем уменьшается;
б)процесс находится в диффузионной области.
Итак, у металлов с плотной окалиной реакция окисления вначале находится в кинетической области и слой окисла нарастает примерно по линейной зависимости (рис.3.2). При значитёльной толщине слоя зависимость становится параболической и процесс лимитируется внутренней диффузией. Между этими крайними случаями лежит переходная область, где у и t связаны уравнением (3.9), учитывающим как особенности кристаллохимического звена, так и диффузии.
Мерой скорости химической реакции является константа скорости химической реакции, температурная зависимость которой экспоненциальна.
К = K'e-E/RT. (3.12)
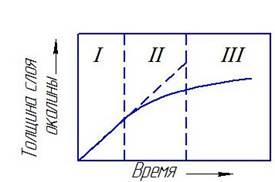
Рис. 3.2. Изменение толщины слои окалины со временем при постоянной температуре: I — кинетическая область; II — переходная область; III — диффузионная область
Мерой скорости диффузии в конденсированных средах является коэффициент диффузии, температурная зависимость которого может быть представлена соотношением:
D = Do· e-E/RT. (3.13)
В уравнениях (3.12) и (3.13) К — константа скорости химической реакции; D - коэффициент диффузии; K'и Do -предэкспоненциальные множители; R — универсальная газовая постоянная; Т - абсолютная температура; F — энергия активации процесса.
Так как окисление металлов и сплавов чаще всего лимитируется диффузией в слое продукта или кристaллохимическим превращением, то температурная зависимость его скорости V оказывается экспоненциальной:
V = С · e-E/RT, (3.14)
где С - постоянная для данного процесса величина. Важнейшая кинетическая характеристика процесса - энергия активации Е - может быть определена методом интерференционной индикации.
Одним из характерных физических признаков протекания гетерогенной химической реакции окисления компактного моно- и поликристаллического металла газообразными реагентами – О2, СО2, Н2О, S2, J2 и другими - следует считать появление на поверхности твердой фазы цветов побежалости. Сущность этого явления имеет интерференционную природу.
Вначале на поверхности твердого тела формируется прозрачная невидимая пленка химического соединения. По мере последующего роста пленки ее толщина и длина хода световых лучей в ней становятся соизмеримыми с длинами волн светового спектра, то есть возникают условия для интерференции света, что схематически помазано на рис.3.3.
Условием погашения какой-либо монохроматической составляющей компонента белого света является равенство оптической разности хода лучей 3 и 4 нечетному числу полуволн:
2h = 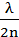 ;
; 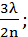
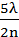 ….. (3.15)
….. (3.15)
где h - толщина слоя продукта на металле; λ - длина волны, монохроматического цвета; n - показатель преломления луча в пленке.
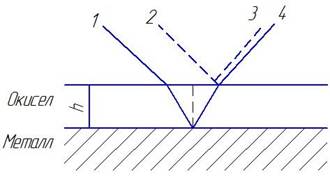
Рис. 3.3. Схема, поясняющая явление интерференционной окрашенности пленок на металлах: 1, 2 -падающие лучи; 3, 4 - отражённые лучи
Если вследствие двойного отражения возникает сдвиг фаз, то его можно рассматривать как дополнительную разность пути. С.
Тогда
h =  - С;
- С;  - С;
- С; 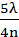 - С ……. (3.16)
- С ……. (3.16)
Погашение одной части светового спектра окрашивает пленку в дополнительный до белого цвета. По мере протекания реакции и утолщения пленки цвет меняется от теплых тонов к холодным в последовательности:
желтый → коричневый → фиолетовый → синий → голубой.
Из условия погашения света вследствие интерференции вытекает, что с ростом пленки цвета побежалости могут повториться, образуя спектр второго, третьего и более высокого порядка. По времени изменения цвета пленки в той или иной реакции можно судить о ее скорости, о влиянии различных внутренних и внешних факторов на кинетику процесса: изменение интерференционной картины во времени делает химическое взаимодействие как бы видимым.
При небольшом интервале изменения толщин слоя продукта а первом приближении можно считать, что рост пленки подчиняется линейному закону, то есть V = coпst. Тогда, истинная скорость окисления становится практически равной средней скорости V
V = 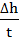 = C · e-E/RT, (3.17)
= C · e-E/RT, (3.17)
где ∆h - приращение толщины пленки; t - время.
При ∆h = const, что соответствует изменению цвета пленки в пределах двух эталонных цветов,
1gt = 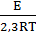 const, (3.18)
const, (3.18)
то есть главными кинетическими характеристиками процесса окисления становятся t и Е.
Уравнение (3.18) предопределяет относительно простой экспериментальный способ определения дифференциальных значений величины энергии активации Е. Создав эталоны интерференционной окрашенности, можно при оксидировании металлом измерять время t изменения толщины пленки в заданных пределах при различных температурах. В соответствии с уравнением (3.18) по графику 1gt = φ(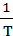 ) определяется величина кажущейся энергии активации процесса.
) определяется величина кажущейся энергии активации процесса.
.
3.2. Методика измерения, аппаратура и порядок выполнения работы
Изотермическое окисление кислородом воздуха металлических образцов производится в печи, питаемой от электросети (рис: 3.4).
Восемь образцов заданного металла или сплава в виде пластин тщательно шлифуют и обезжиривают.
Включают печь в сеть и по достижении заданной руководителем температуры окисляют 4 образца до появления на них желтого, коричневого, фиолетового и синего цветов побежалости. Эти цвета принимаются за эталоны.
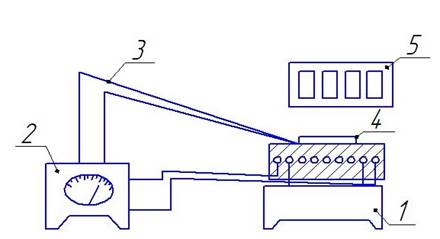
Рис. 3.4. Схема установки для изотермического окисления металлов: 1 - печь; 2 - потенциометр с терморегулятором; 3 -термопара; 4 - образец; 5 - эталоны.
Затем последовательно окисляют оставшиеся образцы при четырех заданных температурах. При этом секундомером измеряют время достижения эталонных цветов пленки полученные, результаты заносят в таблицу.
Температурная зависимость времени изменения интерференционной окрашенности образцов
| T, 0C | T, K |
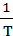 103 103
| Время изменения интерференционной окрашенности, с | |||||
| с от желтой до коричневой | от коричневой до фиолетовой | от фиолетовой до синей | ||||||
| t | lgt | t | lgt | t | lgt | |||
По табличным данным строят график в координатах 1gt = φ(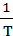 ) для каждого интервала изменения окрашенности образцов.
) для каждого интервала изменения окрашенности образцов.
Согласно уравнению (3.18) зависимость 1gt от 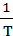 носит линейный характер.
носит линейный характер.
Угловой коэффициент
tgα = 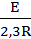 . (3.19)
. (3.19)
Определив тангенс угла полученных прямых с положительным направлением оси абсцисс, по соотношению
Е = 2,3R tga, (3.20)
определяют энергию активации газовой коррозии для всех исследованных интервалов изменения толщины пленки.
В выводах отмечают, как влияет изменение толщины оксидной пленки на величину энергии активации окисления.
3.3. Контрольные вопросы
1. Общая характеристика высокотемпературных гетерогенных металлургических реакций.
2. Многостадийность гетерогенных процессов. Лимитирующая стадия.
3. При каких условиях происходит окисление твердых металлов?
4. Каковы основные стадии процесса окисления твердых металлов? От чего зависит их скорость?
5. Кинетический и диффузионный режимы процесса.
6. Каков механизм окисления твердых металлов?
7. Уравнение Аррениуса. Энергии активации.
8. В чем заключается метод интерференционной индикации?
9.Оцените точность полученных Вами экспериментальных данных.
Дата публикования: 2015-10-09; Прочитано: 554 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
