 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Исследование кинетики изотермического окисления металлов
|
|
2.1. Цель работы.
Установить закон роста окисной пленки во времени при окислении данного металла на воздухе при постоянной температуре.
В металлургическом производстве неизбежно протекают окислительные процессы, связанные с нагревом металла в различных окислительных средах. Обычно различают низко- и высокотемпературное окисление. Первое имеет место, главным образом, в условиях эксплуатаций готовых изделий. Для металлургических процессов наибольшее значение имеет высокотемпературное окисление, которое происходит при нагревании твердого металла в окислительной среде на тех или иных стадиях его передела.
Принципиальная возможность или невозможность самопроизвольного протекания любого химического процесса, в том числе и реакции окисления, определяется знаком изменения термодинамического потенциала. В качестве критерия равновесия и самопроизвольности процесса окисления металлов наиболее удобно пользоваться изобарно-изотермическим потенциалом G. Любой самопроизвольно протекающий изобарно-изотермический процесс сопровождается убылью изобарно-изотермического потенциала (свободной энергии Гиббса) системы. Таким образом, при данных условиях процесс окисления возможен, если ∆G < 0,процесс невозможен, если ∆G > 0; система находится в равновесии, если ∆G = 0
Для реакции окисления металла кислородом
2Ме(ТВ) + О2(газ) = 2МеО(ТВ). (2.1)
суждение. О термодинамической возможности или невозможности процесса может быть сделано непосредственно на основании сравнения парциального давления кислорода РО2 и давления диссоциации образующегося окисла Рмео. Для реакции окисления металла (2.1) изменение изобарно-изотермического потенциала системы можно записать следующим образом:
∆G = RT(lnPO2 – lnP'О2), (2.2)
где PО2 - равновесное, а P'О2 - неравновесное давления кислорода. В обычных атмосферных условиях P'О2 является парциальным давлением кислорода и составляет 0,21 ат. Равновесное давление кислорода P'О2 равно давлению диссоциации (упругости диссоциации) образующегося окисла РМеО•
Так как для большинства технически важных металлов упругость диссоциации их окислов РО2 вплоть до температур плавления гораздо меньше 0,21 ат. то значение ∆G оказывается отрицательным и реакция окисления (2.1) протекает самопроизвольно.
Таким образом, в силу термодинамической неустойчивости подавляющего большинства металлов и сплавов в атмосфере воздуха или других окислительных газов обязательно должна протекать реакция окисления этих металлов. Очень часто образующийся продукт химической реакции - окисел, разделяя реагенты, может резко осложнить и затормозить ход реакции. Скорость процесса окисления зависит от защитных свойств образующихся окисных пленок, т.е. от их сплошности, механической прочности и сопротивления диффузии реагирующих веществ.
Заметными защитными свойствами могут обладать только сплошные окисные пленки, покрывающие всю поверхность металла. Возможность образования такой пленки определяется условием сплошности Пиллинга и Бедвортса, смысл которого сводится к тому, что объем окисла Vок должен быть больше объема металла VМе, израсходованного на образование этого окисла. В противном случае образующегося окисла не хватает, чтобы покрыть сплошным слоем весь металл, в результате чего оксидная пленка получается рыхлой, пористой.
Таким образом, если
Vок /VМе < 1, (2.3)
то пленка не может быть сплошной, если
Vок/VМе > 1, (2.4)
то пленка может быть сплошной.
Отношение объемов окисла и металла можно рассчитать по формуле
 =
=  (2.5)
(2.5)
где Мок - молекулярная масса окисла; АМе - атомная масса металла; m -число атомов металла в молекуле окисла; 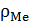 и
и 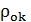 -плотности соответственно металла и окисла.
-плотности соответственно металла и окисла.
В соответствии с условием сплошности пленок все металлы можно разбить на две группы. К первой группе металлов, не удовлетворяющих условию сплошности при окислении их кислородом, относятся все щелочные и щелочно-земельные металлы (за исключением бериллия). Ко второй группе относятся большинство технически важных металлов: А1, Те, Сг, Мn, Fe, Со, Ni, Си и другие.
Защитные свойства пленки определяются рядом факторов, из которых сплошность является необходимым, но недостаточным условием. В реальных условиях роста пленки могут возникать большие внутренние напряжения, которые могут вести к растрескиванию пленки, т.е. нарушению ее сплошности. К нарушению сплошности может приводить большое различие в скоростях диффузии в пленке ионов металла и кислорода. Наконец, некоторые металлы, например молибден, осмий, иридий, образуют при высоких температурах летучие окислы, которые удаляются с поверхности металла, т.е. не обладают защитными свойствами.
Окисление металлов, способных образовывать окислы различного состава, сопровождается ростом оксидных пленок, состоящих из чередующихся слоев окислов с различной степенью окисления. Так, например, поверхность железа при длительном нагреве в окислительном атмосфере выше 570°С покрывается окалиной, имеющей довольно сложное строение в соответствии с диаграммой состояния Fе-О. Внутренний слой оксидной пленки, соприкасающейся с железом, соответствует низшей степени окисления - закиси железа FeO, затем следует слой магнитной окиси железа FезО4 и, наконец, внешний слой окалины состоит из окиси железа Fе2О3, соответствующей наивысшей степени окисления.
Скорость окисления металлов определяется производной от толщины оксидной пленки h по времени t (V =  ).
).
Зависимость вида h = φ(t) называют законом роста пленки. Такого рода закономерности для различных металлов во многих случаях носят формально-кинетический характер, тем не менее их знание представляет большой практический интерес. В последние годы законы роста пленок все в большей мере пытаются увязать о механизмом процесса окисления металлов.
Рост пористой пленки. Пленки, не образующие сплошного и плотного слоя (при Vok / VMe < 1), не являются защитными, так как окисляющий газ сравнительно легко проникает через них к поверхности металла, реагируя с ней. Скорость реакции в атом случае не зависит от толщины образующейся пленки и может быть выражена уравнением
 , (2.6)
, (2.6)
где Кc, - константа скорости химической реакции; С - концентрация окислителя на поверхности металла, не зависящая от времени благодаря очень большой легкости адсорбции окислителя.
Разделив в уравнении (2.6) переменные и проинтегрировав полученное выражение, получим
h = kt + а. (2.7)
Уравнение прямой (2.7) носит название линейного закона роста пленок. В нем а = h при t = 0 т.е. такова толщина пленки на металле перед окислением.
Таким образом, рост пористой (незащитной) пленки контролируется скоростью химической реакции (кинетический контроль процесса) и протекает во времени по линейному закону.
Рост сплошной пленки. Сплошные оксидные пленки на металлах, не имеющие механических дефектов и прочно связанные с металлом, являются защитными, т.е. затрудняют проникновение реагентов - металла и окислителя - друг к другу при их перемещении в слое. Рост таких пленок сопровождается самоторможением процесса, т.е. уменьшением скорости окисления по мере утолщения пленки.
Рост тонких окисных пленок при низких температурах и на первых стадиях окисления металлов при высоких температурах сопровождается большим самоторможением во времени, которому соответствует логарифмический закон.
h= к1g(аt + в), (2.8)
где к, а и в – постоянные, или обратный логарифмический закон
 = а - к1gt, (2.9)
= а - к1gt, (2.9)
где к и а - постоянные.
Существует ряд теорий., объясняющих эти законы роста пленок на основании контроля процесса окисления переносом ионов или электронов а тонких пленках по механизмам, отличающимся от диффузионного.
По мере утолщения образующихся при высокотемпературном окислении металлов пленок перемещение реагентов через них в преобладающем большинстве случаев осуществляется диффузией, движущей силой которой является разность химических потенциалов, или концентрационный градиент. Если исходить из преимущественной диффузии через оксидную плёнку кислорода, то для скорости установившегося стационарного режима процесса можно записать:
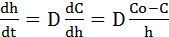 , (2.10)
, (2.10)
где D - коэффициент диффузии кислорода в окисной пленке; Со и С - концентрация кислорода соответственно на внешней и внутренней поверхностях окисной пленки.
При чисто диффузионном контроле процесса, когда, например, весь поступающий в зону реакции кислород успевает прореагировать с металлом, накапливания кислорода на внутренней поверхности пленки не происходит, т.е. С=0, и уравнение (2.10) принимает вид
 . (2.11)
. (2.11)
После разделения переменных интегрирования получим
h2=2DСOt+а = kt+а. (2.12)
Обычно при t = 0, h ≡ 0 и а = 0. Поэтому (2.12) принимает вид:
h2 = kt. (2.13)
Уравнения (2.12) и (2.13) носят название параболического закона роста пленок.
Аналогичное уравнение параболы получается, если исходить из диффузии через окиснув пленку, главным образом металла, или из одновременной диффузии кислорода и металла. Последний случай является наиболее общим и довольно распространенным.
Рост окисной пленки во времени при соизмеримости торможений химической реакции окисления металла и диффузионных процессов в окисной пленке можно описать сложно-параболическим законом окисления (уравнение Эванса).
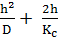 =kt±a. (2.14)
=kt±a. (2.14)
Уравнение Эванса (2.14) позволяет получить как линейны й (при D» Кc) так и параболический (при Кc» D) закон роста пленок.
Объединенный график законов окисления металлов приведен на рис. 2.1.
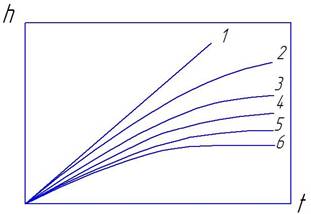
Рис. 2.1. Объединенный график законов роста пленок: I -линейный закон; 2 - сложнопараболический закон; З - параболический закон; 4 — степенной закон; 5 -обратнологарифмический закон; 6 - логарифмический закон
Следует отметить, что окисление большинства технически важных металлов А1, Ti, Ре, Си. и др.) с изменением условий (температуры, состава газа, времени окисления) происходит по разным законам. Повышение температуры приводит к снижению самоторможения окисления металлов.
В некоторых случаях окисление идет сравнительно быстро, затем прекращается (рис.2.1, кривая 6). Образовавшаяся оксидная пленка полностью защищает металл от окисления. Такой характер процесса наблюдается у жаростойких металлов и сплавов. Повышение температуры ускоряет окислительные процессы. Зависимость константы скорости окисления от температуры выражается уравнением
К = Аехр(-Е/RТ), (2.15)
где К - константа скорости окисления; Е - кажущаяся энергия активации реакции окисления; А - постоянная.
Образующиеся при низких температурах оксидные пленки обычно обладают более высокими защитными свойствами, чем пленки, образующиеся ври высоких температурах. В частности, это характерно для алюминия., при низкотемпературном окислении которого образуется тонкая прочная оксидная пленка, предохраняющая его от дальнейшего окисления. При высоких температурах вследствие ускорения диффузии взаимодействующих веществ образуются более толстые и менее прочные пленки, которые в меньшей степени предохраняют металл от окисления.
2.2. Методика измерения, аппаратура и порядок выполнении работы
Включают муфельную печь 3 (рис. 2.2) для ее нагрева до заданной температуры, которая определяется и поддерживается постоянной с помощью термопары 2 и терморегулятора 1.
Затем образцы обезжиривают, протирают фильтровальной бумагой и взвешивают на аналитических весах с точностью до десятых долей миллиграмма. Номер, площадь поверхности и массу образцов заносят в таблицу.
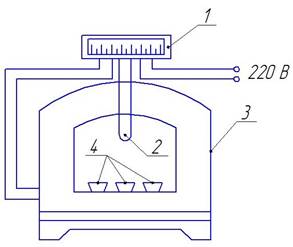
Рис. 2.2. Схема установки для испытания металлов на газовую коррозию в воздухе: 1 - терморегулятор; 2 - термопара; 3 -муфельная печь; 4 - тигли с образцами
Через 20 минут после начала окисления открывают дверцу печи и вынимают щипцами тигель с первым образцом, через 40 минут - со вторым образцом, через 60 минут - с третьим и через 80 минут - с четвертым образцом. Извлеченные тигли ставят на керамическую, подставку для остывания на воздухе. После охлаждения в течение 10 - 15 минут каждый образец взвешивают вместе с тиглем, а затем взвешивают отдельно пустой тигель. По результатам взвешивания находят массы образцов после окисления и заносят их в таблицу.
Запись полученных опытных результатов проводят по форме.
Условии опытов:
материал образца………………………………..,
размер образца.... х …… х.........................мм,
температура …………………………..К.
Результаты измерений
| Номер образца | Площадь образца, S,м2 | Время окисления t, мин | Масса до окисления mo, r | Масса после окисления mt, r | Удельное увеличение массы образца ∆m=(mt-mo)/s г/м2 |
По табличным данным, включая точку, соответствующую началу координат, строят график ∆m = φ(t). Графическим дифференцированием получают график 𝝏∆m/ 𝝏t = φ (t).
Пользуясь справочными данными, рассчитывают объемное отношение для окислов данного металла (2.5). В выводах отмечают, удовлетворяет ли окисел данного металла условию сплошности пленок.
2.3. Контрольные вопросы
1. Термодинамика термического окисления металлов.
2. Пленки на металлах. Условие сплошности пленок.
З. Лимитирующие процессы. термического окисления металлов.
4. Кинетика окисления металлов. Закона роста пленок.
5. Какие металлы окисляются по линейному и параболическому законам?
6. От каких факторов зависит скорость окисления металлов?
7. Температурная зависимость скорости окисления металлов.
8. Состав и структура окисных пленок на металлах.
Дата публикования: 2015-10-09; Прочитано: 1322 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
