 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Методика виконання роботи
|
|
2.1. Визначення вмісту вільного карбону(ІV) оксиду
Вміст у воді вільного СО2 визначають методом нейтралізації. До проби води додають 0,1 N розчин NaOH, внаслідок чого СО2 переходить у гідрогенкарбонат за реакцією
СО2 + NaOH D NaHCO3. (11)
Точка еквівалентності відповідає рН 8,4, тому її визначають з індикатором фенолфталеїном у момент виникнення слабко малинового забарвлення.
Щоб запобігти втратам карбону(IV) оксиду, пробу води відбирають піпеткою із сифоном. Іони Fe2+, які заважають визначенню СО2, усувають додаванням до проби води розчину сегнетової солі.
П о с л і д о в н і с т ь в и з н а ч е н н я
У конічну колбуоб’ємом 250 см3 відбирають піпеткою 100 см3 досліджуваної води, додають 1 см3 30 % розчину сегнетової солі і 5–10 крапель розчину індикатора фенолфталеїну. Пробу титрують 0,1 N розчином NaOH до появи стійкого слабко малинового забарвлення, яке не зникає протягом 1 хв.
Результати першого титрування є орієнтовними, оскільки розчин натрію гідроксиду під час титрування поглинає СО2 із повітря. Друге титрування проводять швидше і його результати використовують для розрахунку вмісту СО2 в мг/дм3
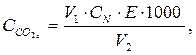 (12)
(12)
де V1 – об’єм 0,1 N розчину NaOH, витраченого на титрування проби води, см3;
V2 – об’єм проби води, см3;
СN – нормальна концентрація розчину NaOH, екв/дм3;
Е – еквівалентна маса СО2, Е = 44 г/екв.
Загальний вміст СО2 (СО2заг, мг/дм3) визначають у тій самій пробі, в якій визначали вміст вільного СО2. Для цього у пробу додають 2–3 краплі розчину індикатора метилоранжу і титрують 0,1 N розчином HCl до переходу забарвлення з жовтого до золотисто-рожевого.
Вміст загального СО2 (мг/дм3) розраховують за формулою
 (13)
(13)
де V2 – об’єм проби води, см3;
V3 – об'єм розчину HCl, витраченого на титрування, см3;
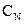 – нормальна концентрація розчину HCl, екв/дм3.
– нормальна концентрація розчину HCl, екв/дм3.
2.2. Визначення лужності води
Загальну лужність визначають титруванням проби досліджуваної води розчином хлоридної кислоти за присутності індикатора метилоранжу.
П о с л і д о в н і с т ь в и з н а ч е н н я
У конічну колбуоб’ємом 250 см3 відбирають піпеткою 100 см3 досліджуваної води, додають 2–3 краплі розчину метилоранжу і титрують 0,1 N розчином HCl до переходу забарвлення розчину з жовтого до золотисто-рожевого.
Загальну лужність (мекв/дм3) розраховують за формулою
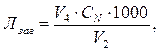 (14)
(14)
де V2 – об’єм проби води, см3;
V4 – об'єм розчину HCl, витраченого на титрування, см3;
СN – нормальна концентрація розчину HCl, екв/дм3.
Визначення лужності за присутності фенолфталеїну. У конічну колбуоб’ємом 250 см3 відбирають піпеткою 100 см3 досліджуваної води, додають 5–10 крапель розчину індикатора фенолфталеїну і, якщо з'являється червоно-рожеве забарвлення, титрують 0,1 N розчином HCl до знебарвлення.
Лужність за фенолфталеїном (мекв/дм3) розраховують за формулою
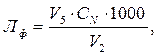 (15)
(15)
де V2 – об’єм проби води, см3;
V5 – об'єм розчину HCl, витраченого на титрування, см3;
СN – нормальна концентрація розчину HCl, екв/дм3.
Якщо забарвлення після додавання фенолфталеїну відсутнє, то лужність за фенолфталеїном дорівнює нулю – ЛФ = 0.
На підставі отриманих результатів досліджень потрібно розрахувати усі форми лужності води (гідратну, карбонатну і гідрогенкарбонатну), користуючись формулами, наведеними у табл. 1.
Під час перевірки результатів за допомогою номограми (рис. 2) слід порівняти експериментальні і розрахункові значення рН досліджуваної води.
Отримані результати заносять у табл. 2.
Таблиця 2
Результати досліджень
| Вміст СО2, мг/дм3 | Лужність, мекв/дм3 | рН | ||||||
| СО2 в | СО2 заг | Лзаг | ЛФ | Лгідрогенкарб | Лкарб | Лгідр | експери-ментальне | розра-хункове |
3. СТАБІЛЬНІСТЬ ВОДИ І МЕТОДИ ЇЇ ВИЗНАЧЕННЯ
3.1. Визначення рівноважного і агресивного СО2
Воду називають стабільною, якщо під час контактування з бетонними і металевими поверхнями вона не змінює свого хімічного складу. Згідно з Державним стандартом, стабільною вважають воду, яка не розчиняє кальцію карбонат і з якої він не виділяється.
Найчастіше причиною нестабільності води щодо бетону є агресивний карбону(IV) оксид.
У природних водах встановлюється динамічна хімічна рівновага між різними формами СО2, яку за наявності іонів Кальцію виражають рівнянням
СаСО3 + СО2 + Н2О D Са2+ + 2НСО3–. (16)
Константу рівноваги цієї системи виражають рівнянням
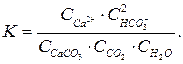 (17)
(17)
Концентрації 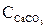 та
та  – величини сталі, тому їх об’єднують з константою рівноваги К, тоді
– величини сталі, тому їх об’єднують з константою рівноваги К, тоді
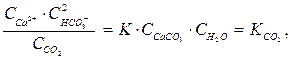 (18)
(18)
де 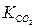 – константа рівноваги.
– константа рівноваги.
Із наведеного рівняння (18) випливає, що гідрогенкарбонат-іони можуть перебувати у природних водах тільки за присутності вільного СО2. Причому певному вмісту іонів НСО3– відповідає певна кількість вільного СО2, яку називають рівноважною – 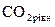 . Її можна розрахувати за величиною константи рівноваги
. Її можна розрахувати за величиною константи рівноваги 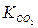 . Для розведених розчинів за температури 25 0С
. Для розведених розчинів за температури 25 0С 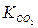 = 3,43·10–5, якщо концентрації
= 3,43·10–5, якщо концентрації 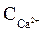 і
і 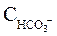 виражені в екв/дм3. Якщо ж результати аналізу води виражені в мекв/дм3, то
виражені в екв/дм3. Якщо ж результати аналізу води виражені в мекв/дм3, то 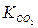 = 34,3.
= 34,3.
Концентрацію рівноважного СО2 (ммоль/дм3) визначають за формулою
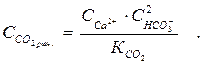 (19)
(19)
Порівнюючи вміст у воді 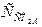 з розрахунковою величиною
з розрахунковою величиною 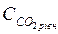 , формулюють висновок про стабільність води.
, формулюють висновок про стабільність води.
За умови, якщо
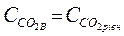 ,
,
воду називають стабільною. Якщо вміст вільного СО2 не дорівнює вмісту рівноважного − вода нестабільна. Нестабільність води може бути двоякою. Якщо 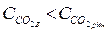 рівновага реакції (16) зміщується ліворуч, що спричиняє осадження кальцію карбонату. Таку воду називають схильною до відкладення кальцію карбонату.
рівновага реакції (16) зміщується ліворуч, що спричиняє осадження кальцію карбонату. Таку воду називають схильною до відкладення кальцію карбонату.
Якщо 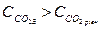 рівновага реакції (16) зміщується праворуч – відбувається розчинення кальцію карбонату. Таку воду називають агресивною. У цьому разі надлишок карбону(ІV) оксиду (СО2агр) спричиняє корозію металевих і бетонних споруд.
рівновага реакції (16) зміщується праворуч – відбувається розчинення кальцію карбонату. Таку воду називають агресивною. У цьому разі надлишок карбону(ІV) оксиду (СО2агр) спричиняє корозію металевих і бетонних споруд.
Для розрахунку агресивного СО2 найчастіше використовують таблиці Леманна і Реусса (табл. 3). Початковими даними для розрахунку є результати визначення  (мг/дм3) і загальної лужності Лзаг (мекв/дм3).
(мг/дм3) і загальної лужності Лзаг (мекв/дм3).
Вміст агресивного карбону(ІV) оксиду (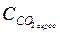 , мг/дм3) розраховують за формулою
, мг/дм3) розраховують за формулою
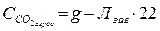 , (20)
, (20)
де g – сума гідрогенкарбонатного і агресивного СО2, мг/дм3.
Значення g пов’язане з сумарним вмістом вільного і гідрогенкарбонатного СО2, мг/дм3. Сумарний вміст вільного і гідрогенкарбонатного СО2 (S) визначають з одержаних експериментальних результатів, а значення g – з табл.3
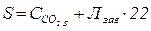 . (21)
. (21)
Приклад. Визначити стабільність води, якщо аналізом встановлено, що 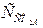 = 44 мг/дм3;
= 44 мг/дм3; 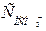 =122 мг/дм3;
=122 мг/дм3; 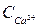 = 80 мг/дм3; а Лзаг = 2 мекв/дм3.
= 80 мг/дм3; а Лзаг = 2 мекв/дм3.
Спочатку розраховують вміст рівноважного СО2. Для цього результати аналізу перераховують у ммоль/дм3 :
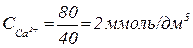 ;
; 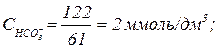
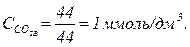
Таблиця 3
Дані для розрахунку агресивного карбону(IV) оксиду
| S | g | S | g | S | g | S | g | S | g |
| 43,0 | 77,3 | 104,3 | 126,2 | ||||||
| 43,9 | 78,0 | 104,8 | 126,6 | ||||||
| 44,7 | 78,7 | 105,4 | 127,0 | ||||||
| 45,6 | 79,3 | 105,9 | 127,5 | ||||||
| 46,5 | 80,0 | 106,5 | 127,9 | ||||||
| 47,3 | 80,8 | 106,9 | 128,4 | ||||||
| 48,2 | 81,4 | 107,5 | 128,6 | ||||||
| 49,0 | 82,1 | 108,1 | 129,2 | ||||||
| 49,0 | 82,7 | 108,6 | 129,7 | ||||||
| 50,7 | 83,3 | 109,1 | 130,2 | ||||||
| 51,5 | 84,0 | 109,6 | 130,6 | ||||||
| 52,4 | 84,6 | 110,2 | 131,0 | ||||||
| 53,2 | 85,3 | 110,7 | 131,4 | ||||||
| 13,9 | 54,0 | 85,9 | 111,2 | 131,9 | |||||
| 14,9 | 54,8 | 86,5 | 111,7 | 132,3 | |||||
| 15,9 | 55,7 | 87,2 | 112,2 | 132,7 | |||||
| 16,9 | 56,5 | 87,6 | 112,5 | 133,2 | |||||
| 17,8 | 57,2 | 88,4 | 113,2 | 133,7 | |||||
| 18,8 | 58,1 | 89,1 | 113,7 | 134,0 | |||||
| 19,8 | 58,8 | 89,7 | 114,2 | 134,4 | |||||
| 20,8 | 59,6 | 90,4 | 114,7 | 134,8 | |||||
| 21,7 | 60,4 | 90,9 | 115,3 | 135,2 | |||||
| 22,7 | 61,2 | 91,6 | 115,8 | 135,7 | |||||
| 23,7 | 62,0 | 92,2 | 116,3 | 136,0 | |||||
| 24,6 | 62,8 | 92,8 | 116,6 | 141,6 | |||||
| 25,6 | 63,5 | 93,4 | 117,3 | 145,6 | |||||
| 26,5 | 64,3 | 94,0 | 117,6 | 149,8 | |||||
| 27,5 | 65,0 | 94,6 | 118,1 | 153,8 | |||||
| 28,4 | 65,8 | 95,1 | 118,6 | 157,5 | |||||
| 29,4 | 66,5 | 95,8 | 119,1 | 161,2 | |||||
| 30,3 | 67,3 | 96,3 | 119,6 | 164,9 | |||||
| 31,2 | 68,0 | 97,0 | 120,1 | 168,5 | |||||
| 32,2 | 68,8 | 97,6 | 120,6 | 171,9 | |||||
| 33,1 | 69,5 | 98,1 | 121,0 | 175,3 | |||||
| 34,0 | 70,3 | 98,6 | 121,5 | 178,8 | |||||
| 34,9 | 71,0 | 99,2 | 122,0 | 182,1 | |||||
| 35,9 | 71,7 | 99,8 | 122,5 | 185,0 | |||||
| 36,8 | 72,4 | 100,4 | 123,0 | 188,3 | |||||
| 37,7 | 73,1 | 100,9 | 123,4 | 191,3 | |||||
| 38,6 | 73,8 | 101,5 | 123,9 | 194,2 | |||||
| 39,5 | 74,5 | 102,1 | 124,3 | 197,3 | |||||
| 40,3 | 75,2 | 102,6 | 124,7 | 199,9 | |||||
| 41,2 | 75,9 | 103,2 | 125,2 | 202,8 | |||||
| 42,1 | 76,5 | 103,7 | 125,7 | 205,7 |
Тоді 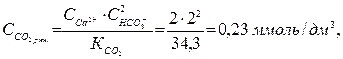
або 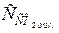 = 0,23 · 44 = 10,12 мг/дм3.
= 0,23 · 44 = 10,12 мг/дм3.
На основі отриманих результатів розрахунку можна зробити попередній висновок, що вода агресивна щодо бетону, оскільки рівноважна концентрація 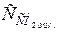 .= 10,12 мг/дм3, а вміст у воді
.= 10,12 мг/дм3, а вміст у воді 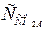 = 44 мг/дм3, тобто
= 44 мг/дм3, тобто  >
> 
Кількість агресивного СО2 розраховуємо за даними, наведеними у табл. 3. Порядок користування таблицею такий:
1) визначаємо суму вільного і гідрогенкарбонатного СО2:
S =  + Л заг·22 = 44 + 2·22 = 88 мг/дм3;
+ Л заг·22 = 44 + 2·22 = 88 мг/дм3;
2) Знаходимо значення g, яке відповідає S = 88 мг/дм3 (табл. 3): g = 76,5 мг/дм3;
3) Розраховуємо вміст агресивного СО2 (мг/дм3)
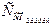 = g – Л заг·22 = 76,5 – 2·22 = 32,5 мг/дм3.
= g – Л заг·22 = 76,5 – 2·22 = 32,5 мг/дм3.
Відтак вміст у досліджуваній воді вільного СО2 становить 44 мг/дм3, рівноважного – 10,12 мг/дм3 і агресивного – 32,5 мг/дм3. Слід звернути увагу на те, що кількість агресивного СО2 не дорівнює різниці між СО2 вільним і рівноважним, а завжди відрізняється від неї (32,5 < (44 – 10,12)). Це пояснюється тим, що частина розчиненого СО2 переходить у рівноважний під час утворення кальцію гідрогенкарбонату.
3.2. Розрахунок індексу стабільності
(індексу насичення води кальцію карбонатом)
У практиці водопостачання стабільність води визначають за величиною індексу стабільності
І = рН0 – рН, (22)
де рН0, рН – величина рН води фактична (виміряна) і та, яка відповідає повному насиченню цієї води кальцію карбонатом відповідно.
Величину рН визначають розрахунковим методом за температурою води (Т, 0С), концентрацією іонів Кальцію (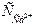 , мг/дм3), лужністю води (Лзаг, мекв/дм3), загальним солевмістом (Р, мг/дм3). За допомогою номограми (рис. 3)
, мг/дм3), лужністю води (Лзаг, мекв/дм3), загальним солевмістом (Р, мг/дм3). За допомогою номограми (рис. 3)

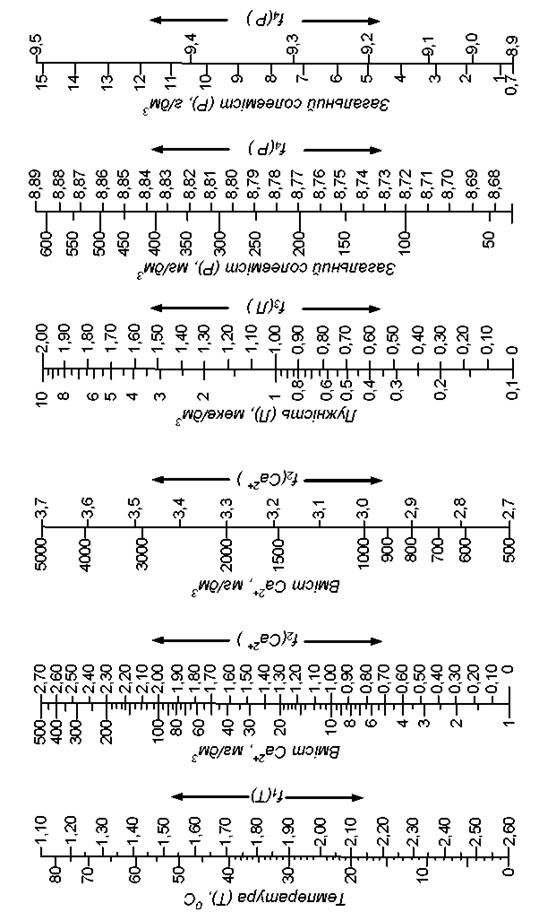
знаходять значення функцій від цих аргументів та розраховують рН
рН = f1(Т) – f2(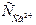 ) – f3(Лзаг.) + f4(P). (23)
) – f3(Лзаг.) + f4(P). (23)
Воду вважають стабільною, якщо І = 0. За додатного значення індексу стабільності (І > 0) вода схильна до відкладення кальцію карбонату. За від’ємного значення (І < 0) вода є агресивною щодо металу та бетону, тому необхідне її стабілізаційне оброблення.
Точність визначення стабільності води розрахунковим методом залежить від багатьох чинників, тому отримані результати завжди є наближеними. Для остаточного висновку, особливо під час встановлення агресивності води, необхідне експериментальне підтвердження отриманих результатів методом карбонатних випробувань згідно з Державним стандартом.
3.3. Метод карбонатних випробувань
Метод базується на порівнянні загальної лужності води до і після її контактування з хімічно чистим кальцію карбонатом.
За результатами випробувань розраховують показник стабільності, який дорівнює відношенню загальної лужності Лзаг до лужності, що відповідає повному насиченню води кальцію карбонатом Лнас
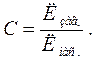 (24)
(24)
Воду вважають стабільною, якщо С = 1, якщо С більше або менше 1 – нестабільною. Якщо показник стабільності С > 1, вода схильна до відкладання надлишкового кальцію карбонату в осад. Якщо С < 1, воду вважають агресивною щодо бетонних та металевих споруд.
П о с л і д о в н і с т ь в и з н а ч е н н я
Пробу води у скляному бутлі об'ємом не менше 2 дм3, заповненому до корка, доправляють у лабораторію для дослідження. Швидко відмірюють піпеткою 100 см3 досліджуваної води, в якій визначають загальну лужність. Потім у склянку або колбу об'ємом 500 см3 відмірюють циліндром 400 см3 води і туди ж додають 3 г хімічно чистого порошкоподібного кальцію карбонату. Склянку закривають гумовим корком та поміщають в апарат для струшування на 1– 2 години. Після припинення струшування корок швидко замінюють іншим, в який вставлена трубка з натронним вапном та сифонна трубка. Пробу фільтрують через пористий скляний фільтр № 2, відбирають піпеткою 100 см3 води та визначають лужність Лнас. Розраховують показник стабільності С, за величиною якого роблять висновок про стабільність води.
Стабільність води визначають під час вибору джерела водопостачання, для проведення будівельних робіт і контролю властивостей води на діючих установках та промислових об’єктах. Результати заносять у таблицю 4.
Таблиця 4
Результати досліджень і розрахунків
| Лзаг, мекв/дм3 | Лнас., мекв/дм3 | Показник стабільності води С | Висновок про стабільність води |
Для порівняння розрахункових і експериментальних даних усі результати досліджень стабільності води зводять у загальну таблицю 5.
Таблиця 5
Результати досліджень і розрахунків
| рН води експ. | 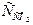 , мг/дм3 , мг/дм3
| Індекс стабільності, І | Показник стабільності, С | Висновок про стабільність води | ||
| вільного | рівноваж-ного | агресив-ного | ||||
4. ВИМОГИ ТЕХНІКИ БЕЗПЕКИ ПІД ЧАС ВИКОНАННЯ ЛАБОРАТОРНОЇ РОБОТИ
1. Усі роботи необхідно виконувати, ретельно дотримуючись вимог загальних правил техніки безпеки та пожежної безпеки під час роботи в хімічній лабораторії.
2. Під час виконання роботи необхідно бути обережним, пам’ятати, що неакуратність, неуважність, недостатнє ознайомлення з лабораторним обладнанням та властивостями речовин, які використовують, можуть спричинити нещасні випадки.
3. Виконувати роботу, не відволікаючи уваги сторонніми справами і розмовами.
4. Жодні речовини, навіть воду, не куштувати на смак.
5. Аналізи проводити тільки з такими кількостями і концентраціями речовин, які вказані в цій інструкції.
6. Бути обережним під час роботи з кислотами (визначенні вмісту гідрогенкарбонат-іонів) і лугами (визначенні вільного СО2). У разі потрапляння цих розчинів на шкіру швидко змити їх великою кількістю води та обробити ізотонічним розчином натрію гідрогенкарбонату або 2 % мас. розчином борної кислоти відповідно.
5. ВИМОГИ ДО ЗВІТУ
Лабораторну роботу необхідно оформити у робочому зошиті, де повинні бути написані методики аналізів і розрахунків.
У звіті наводять методики аналізів та розрахунків; отримані експериментальні та розрахункові результати вносять у відповідні таблиці. На підставі результатів досліджень формулюють висновки.
6. КОНТРОЛЬНІ ПИТАННЯ
1. Як класифікують форми карбону(IV) оксиду, що містяться у воді?
2. Чим зумовлена лужність води?
3. Яку воду називають стабільною?
4. Як визначають показник стабільності води?
5. Як розраховують індекс стабільності води?
6. Які хімічні реакції перебігають під час руйнування бетону під дією агресивної води?
7. Вкажіть формулу осаду, який утворюється у воді, схильній до відкладення солей.
8. Які види стабілізаційного оброблення застосовують для усунення агресивності води?
9. Як стабілізують воду, схильну до відкладення солей.
5. РЕКОМЕНДОВАНА ЛІТЕРАТУРА
1. Яворський В.Т. Теоретичні основи хімії: Підручник. − Львів׃ Вид-во Нац. ун-ту “Львівська політехніка”, 2010. − 256 с.
2. Яворський В.Т. Неорганічна хімія: Підручник. − Львів׃ Вид-во Нац. ун-ту “Львівська політехніка”, 2012. − 268 с.
3. Запольський А.К. Водопостачання, водовідведення та якість води. – К.: Вища школа, 2005. – 671 с.
4. Тугай А.М.,Орлов В.О. Водопостачання: Підручник. – К.: Знання, 2009. – 735 с.
5. Запольський А.К., Мішкова-Клименко Н.А., Астрелін І.М., Брик М.Т., Гвоздяк П.І., Князькова Т.В. Фізико-хімічні основи технології очищення стічних вод. – К.: Лібра, 2000. – 552 с.
6. Кульский Л.А. Основы химии и технологии воды. – К.: Наук. думка, 1991. – 568 с.
7. Кульский Л.А. Теоретические основы и технология кондиционирования воды. – К.: Наук. думка, 1983. – 528 с.
8. Кульский Л.А., Гороновский И.Т., Когановский А.М., Шевченко М.А. Справочник по свойствам, методам анализа и очистке воды. – К.: Наук. думка, 1980. – Ч.1,2. – 1206 с.
9. Кульский Л.А., Накорчевская В.Ф. Химия воды. – К.: Вища школа, 1983. – 239 с.
10. Клячко В.А., Апельцин И.Э. Очистка природных вод. – М.: Изд-во литературы по строительству, 1971. – 575 с.
11. Таубе П.Р., Баранова А.Г. Практикум по химии воды. – М.: Высш. школа, 1971. – 128с.
12. Державні санітарні норми та правила “Гігієнічні вимоги до води питної, призначеної для споживання людиною” (ДСанПіН 2.2.4-171-10).
НАВЧАЛЬНЕ ВИДАННЯ
ВИЗНАЧЕННЯ ФОРМ КАРБОНУ(ІV) ОКСИДУ І СТАБІЛЬНОСТІ ПРИРОДНИХ ВОД
Методичні вказівки та інструкція
до лабораторної роботи з курсів “Теоретичні основи хімії і технології води” для студентів базового напряму 6.051301 “Хімічна технологія”
і “Хімія води і мікробіологія” для студентів базового напряму 6.060103 “Гідротехніка (водні ресурси)”
Укладачі Яворський Віктор Теофілович
Савчук Людмила Василівна
Знак Зеновій Орестович
Оленич Роман Романович
Дата публикования: 2015-10-09; Прочитано: 488 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
