 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Затверджено
|
|
на засіданні кафедри
хімії і технології неорганічних речовин
Протокол № 1 від 27.08.2014 р.
Львів – 2014
Визначення форм карбону(ІV) оксиду і стабільності природних вод:Методичні вказівки та інструкція до лабораторної роботи з курсів “Теоретичні основи хімії і технології води” для студентів базового напряму 6.051301 “Хімічна технологія” і “Хімія води і мікробіологія” для студентів базового напряму 6.060103 “Гідротехніка (водні ресурси)”/Укл.: В.Т.Яворський, Л.В.Савчук, З.О.Знак, Р.Р.Оленич – Львів: Видавництво Львівської політехніки, 2014. –19 с.
Укладачі Яворський В.Т., д-р техн. наук, проф.,
Cавчук Л.В., канд. техн. наук, доц.,
Знак З.О., д-р техн. наук, проф.,
Оленич Р.Р., канд. хім. наук, доц.
Відповідальний за випуск Яворський В.Т., д-р техн. наук, проф.
Рецензент Вахула Я.І., д-р техн. наук, проф.
Мета роботи: засвоєння студентами методик визначення вмісту окремих форм карбону(ІV) оксиду в природних водах та стабільності води.
1. ТЕОРЕТИЧНІ ВІДОМОСТІ
1.1. Форми карбону(ІV) оксиду в природних водах
Карбону(ІV) оксид потрапляє у воду внаслідок розкладання органічних залишків у природних умовах – у воді та ґрунтах. Окрім того, природні поверхневі води безпосередньо контактують з повітрям, яке містить 0,045 % мас. карбону(ІV) оксиду. Тому природні води завжди містять певну кількість СО2 фізично розчиненого (вільного СО2) та хімічно зв'язаного у формах Н2СО3, МеСО3, Ме(НСО3)2. Прийнято загальний вміст карбону(ІV) оксиду у водах виражати у перерахунку на вільний СО2 (мг∕дм3).
Процеси, які відбуваються у СО2-вмісних природних водах, можна описати такими рівняннями׃
СО2(г) D СО2(р), (1)
СО2(р) + Н2О D Н2СО3 , (2)
Н2СО3 D Н+ + НСО3−, (3)
НСО3− D Н+ + СО32−, (4)
2 МеСО3+ 2Н2О D Ме(НСО3)2+ Ме(ОН)2, (5)
Ме(НСО3)2D Ме2++ 2НСО3− , (6)
Ме(ОН)2 D МеОН+ + ОН−. (7)
У підсумку, у водах встановлюється динамічна рівновага між вільним СО2 та продуктами перебігу процесів (2) – (7), які визначають вміст у воді окремих іонів.
Розчинність СО2 у воді порівняно висока; наприклад, за температури 0 оС вона становить 1,7 дм3 на 1 дм3 води або 1964 мг∕дм3. Насправді загальний вміст вільного СО2 у поверхневих водах не перевищує 20 мг∕дм3, у підземних − до 40 мг∕дм3. Карбонатна кислота, що утворюється (реакція 2) належить до дуже слабких кислот, а, відтак, ця рівновага сильно зміщена ліворуч. Отже, є підстави вважати, що карбону(ІV) оксид у воді перебуває переважно у вільному стані.
Розчинений у воді карбону(IV) оксид частково реагує з нею, утворюючи слабку карбонатну кислоту Н2СО3. Цю форму називають хімічно зв'язаною формою і характеризують сумою Н2СО3 і СО2. У цьому разі вміст Н2СО3 перераховують на СО2.
Гідрогенкарбонат- та карбонат-іони у воді називають гідрогенкарбонатною і карбонатною формами СО2 відповідно. Сумарний вміст усіх трьох форм (вільного, гідрогенкарбонатного і карбонатного) складає загальний вміст СО2 (СО2 заг, мг/дм3).
Карбонатна кислота дисоціює у воді у дві стадії (процеси (3) і (4)). Константи дисоціації для першого та другого ступенів за температури 25 0С дорівнюють відповідно:
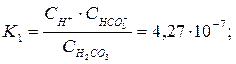

Їх величини відрізняються приблизно на чотири порядки, внаслідок чого у природних водах, переважно, містяться гідрогенкарбонат-іони, а вміст карбонат-іонів дуже незначний.
Із рівнянь дисоціації карбонатної кислоти (рівняння (3) і (4)) також випливає, що концентрації вільного СО2, іонів НСО3− і СО32− перебувають у кількісному взаємозв'язку з рН води. Для перевірки результатів аналізу і розрахунку рН води користуються номограмами (рис. 1). Якщо аналізи проведені якісно, то розходження між експериментальним і розрахунковим значенням рН зазвичай не перевищує 0,2−0,3 одиниць.
Практично можна вважати, що за рН ≤ 4,5 у природних водах міститься тільки вільний СО2, в інтервалі рН 4,5…8,4 у воді присутні вільний СО2 та іони НСО3−. У разі подальшого підвищення рН вільний СО2 у воді відсутній, а поряд з іонами НСО3− з'являються карбонат-іони СО32−, які за рН >10,5 стають переважаючими (рис.2). Вміст (у % мольних) вільного СО2, іонів НСО3- та СО32- у воді від рН водного середовища можна виразити відповідними залежностями:
 ;
;
 ;
;
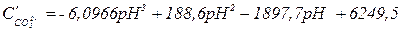
За відсутності у воді розчинених карбонатів (гідрогенкарбонатів) металів реакція середовища за рахунок перебігу процесів (3) і (4) повинна бути кислою, тобто рН повинен бути меншим 7. За відсутності карбонатів рН природних вод повинно становити приблизно 4,5. Але іони Н+ зв’язуються іонами ОН−, СО32− і НСО3−, внаслідок чого рН води має вищі значення.
 
|

Рис.2. Залежність форм карбону(IV) оксиду від рН середовища
1.2. Лужність води
У разі присутності розчинених карбонатів, що характерно для природних вод, за рахунок реакції гідролізу солей (реакція 5) та дисоціації продуктів гідролізу (рівняння 6 і 7) рН води зростає – стає більшим 7 (навіть доходить до 10…11), тобто вода стає лужною. Унаслідок зазначеного для характеристики вод з рН >7 введено поняття лужність води, яка залежить від співвідношення іонів, що утворюються під час перебігу вищенаведених реакцій і, зокрема, концентрації іонів Н+ і ОН−.
Загальну лужність (Лзаг) визначають титруванням проби води розчинами сильних кислот певної нормальності; її виражають у мекв/дм3. Загальна лужність води зумовлена наявністю у ній іонів НСО3−, СО32− та ОН−. Під час титрування розчинами кислот відбуваються такі реакції:
ОН− + Н+ → Н2О, (8)
СО32− + Н+ → НСО3−, (9)
НСО3− + Н+ → СО2 + Н2О. (10)
Розрізняють такі форми лужності: загальну, гідрогенкарбонатну, карбонатну і гідратну. Вони, крім загальної, кількісно дорівнюють концентрації відповідних іонів (мекв/дм3). Для їх роздільного визначення необхідно, крім загальної лужності за метилоранжем (ЛМ), визначити лужність за фенолфталеїном (ЛФ). Цей індикатор має перехід забарвлення за рН 8,2−10,0 (безколірний у кислому середовищі, малиновий − у лужному).
Під час титрування проби води, яку досліджують, розчином хлоридної кислоти за присутності фенолфталеїну відбувається нейтралізація лише іонів ОН− і СО32− за реакціями (8) і (9). Вміст окремих форм лужності розраховують за формулами, наведеними в табл. 1.
Таблиця 1
Формули для розрахунку гідратної, карбонатної і гідрогенкарбонатної лужності води
| Співвідношення ЛМ і ЛФ | Форми лужності води | Формула розрахунку форм загальної лужності | ||
| гідрогенкарбонат-іони (НСО3−), мекв/дм3 | карбонат-іони (СО32−) мекв/дм3 | гідроксидні іони (ОН−), мекв/дм3 | ||
| ЛФ =0 | гідрогенкарбонати | ЛМ | ||
| 2 ЛФ < ЛМ | гідрогенкарбонати і карбонати | ЛМ − 2 ЛФ | 2 ЛФ | |
| 2 ЛФ = ЛМ | карбонати | 2 ЛФ | ||
| 2 ЛФ > ЛМ | карбонати і гідроксидні іони | 2(ЛМ − ЛФ) | 2 ЛФ − ЛМ | |
| ЛФ = ЛМ | гідроксидні іони | ЛМ |
ЛФ − лужність води за фенолфталеїном, мекв/дм3;
ЛМ − лужність загальна за метилоранжем, мекв/дм3.
Дата публикования: 2015-10-09; Прочитано: 227 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
