 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Правила коагуляции коллоидных систем электролитами
|
|
1. Для начала коагуляции необходимо превысить некоторую минимальную концентрацию электролита. Эта величина, выраженная
в ммоль/дм3 и называется порогом медленной коагуляции (С к). Величина, обратная порогу коагуляции, называется коагулирующей способностью (Р). Концентрация электролита, с которой скорость коагуляции перестает зависеть от концентрации, называется порогом быстрой коагуляции.
2. Коагулирующее действие оказывает ион, заряд которого противоположен заряду коллоидной частицы. Например, для положительно заряженного золя (AgI):
{ m [AgI]∙ n Ag+(n – x) NO3−} x +∙ x NO3–,
коагуляторами будут анионы.
3. Правило Шульце – Гарди: величина порога коагуляции данного коллоидного раствора зависит от заряда иона-коагулятора, причем чем выше заряд этого иона, тем ниже величина порога коагуляции. Значения порогов коагуляции для одно-, двух- и трехзарядных ионов примерно обратно пропорциональны 6-й степени их зарядности.
Количественно эта закономерность описывается эмпирическим правилом Шульце – Гарди:
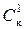 :
: 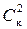 :
: 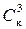 =
= 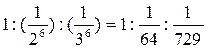 ,
,
где 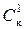 ,
, 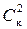 ,
, 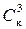 – порог коагуляции одно-, двух-, трехзарядного иона-коагулянта.
– порог коагуляции одно-, двух-, трехзарядного иона-коагулянта.
4. Коагулирующая способность (Р) катионов и анионов одинаковой зарядности возрастает по мере увеличения радиуса иона, т. к. в этом случае уменьшается гидратная оболочка и гидратированный ион сильнее притягивается к заряженной поверхности.
Например, для катионов щелочных металлов получен следующий ряд:
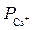 >
>  >
> 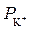 >
> 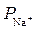 >
> 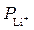 .
.
Для анионов:
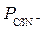 >
> 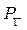 >
> 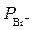 >
> 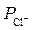 .
.
Чем сильнее гидратирован ион, тем в большей степени гидратная оболочка экранирует его заряд и тем слабее его притяжение к противоположно заряженной поверхности. В результате его коагулирующая способность уменьшается.
5. Коагулирующая способность многих органических веществ намного выше неорганических, что связано с их высокой адсорбционной способностью.
6. Коагуляция смесью электролитов.
При коагуляции коллоидных растворов смесью электролитов возможны три случая:
а) коагулирующее действие суммируется, т. е. наблюдается аддитивное действие, как, например, для смеси электролитов NaCl + KCl;
б) снижение коагулирующего действия одного иона в присутствии другого (антогонизм) наблюдается у ионов различной зарядности, например антогонизм ионов Al3+ и K+ при коагуляции отрицательно заряженных коллоидных частиц AgI;
в) синергизм – взаимное усиление коагулирующей способности ионов, например при коагуляции отрицательно заряженного золя золота коагулирующее действие смеси электролитов LiCl + CsCl усиливается и превышает сумму коагулирующих способностей отдельных электролитов.
Дата публикования: 2015-10-09; Прочитано: 926 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
