 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Теоретические пояснения. Химический характер какого-либо металла в значительной степени обусловлен тем, насколько он легко окисляется
|
|
Химический характер какого-либо металла в значительной степени обусловлен тем, насколько он легко окисляется, т.е. насколько легко его атомы способны переходить в состояние положительных ионов.
Металлы, которые проявляют легкую способность окисляться, называются неблагородными. Металлы, которые окисляются с большим трудом, называются благородными.
Каждый металл характеризуется определенным значением стандартного электродного потенциала. За стандартный потенциал j0 данного металлического электрода принимается ЭДС гальванического элемента, составленного из стандартного водородного электрода, расположенного слева, и пластинки металла, помещенной в раствор соли этого металла, причем активность (в разбавленных растворах можно использовать концентрацию) катионов металла в растворе должна бать равна 1 моль/л; Т=298 К; р=1 атм. (стандартные условия). Если условия реакции отличны от стандартных, нужно учитывать зависимость электродных потенциалов от концентраций (точнее активностей) ионов металлов в растворе и температуры.
Зависимость электродных потенциалов от концентрации выражается уравнением Нернста, которое применительно к системе:
Men++ n e- → Me
Можно записать в следующем виде:
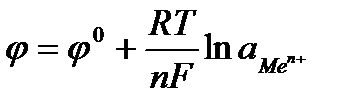 ,
,
где 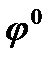 - стандартный электродный потенциал, В;
- стандартный электродный потенциал, В;
R – газовая постоянная, 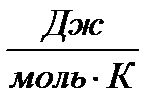 ;
;
F – постоянная Фарадея (»96500 Кл/моль);
n – число электронов, участвующих в процессе;
аМеn+ - активность ионов металла в растворе, моль/л.
Принимая значение Т =298 К, получим
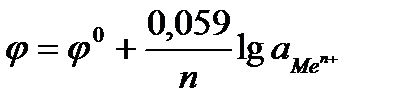
причем активность в разбавленных растворах можно заменить концентрацией ионов, выраженной в моль/л.
Располагая металлы в порядке возрастания величины их стандартных электродных потенциалов j0, отвечающих полуреакции восстановления, получают ряд напряжений металлов (ряд стандартных электродных потенциалов). В этот же ряд помещают стандартный электродный потенциал водорода, принимаемый за нуль, для системы, в которой протекает процесс:
2Н++2е- = Н2
При этом, стандартные электродные потенциалы неблагородных металлов имеют отрицательное значение, а благородных – положительное.
Электрохимический ряд напряжений металлов
Li; K; Ba; Sr; Ca; Na; Mg; Al; Mn; Zn; Cr; Fe; Cd; Co; Ni; Sn; Pb; ( H); Sb; Bi; Cu; Hg; Ag; Pd; Pt; Au
Этот ряд характеризует окислительно-восстановительную способность системы «металл – ион металла» в водных растворах при стандартных условиях. Чем левее в ряду напряжений стоит металл (чем меньше его j0), тем более сильным восстановителем он является, и тем легче атомы металла отдают электроны, превращаясь в катионы, но катионы этого металла труднее присоединяют электроны, превращаясь в нейтральные атомы.
Окислительно-восстановительные реакции с участием металлов и их катионов идут в том направлении, при котором металл с меньшим электродным потенциалом является восстановителем (т.е. окисляется), а катионы металла с большим электродным потенциалом – окислителями (т.е. восстанавливаются). В связи с этим для электрохимического ряда напряжений металлов характерны следующие закономерности:
1. каждый металл вытесняет из раствора солей все другие металлы, стоящие правее его в электрохимическом ряду напряжений металлов.
2. все металлы, которые в электрохимическом ряду напряжений стоят левее водорода, вытесняют водород из разбавленных кислот.
Дата публикования: 2015-10-09; Прочитано: 300 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
