 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Классификация химических реакций
|
|
К ак было сказано выше, химический процесс составляет главную под-систему – химического превращения сырья. Химические реакции классифицируют по ряду признаков.
1. По фазовому состоянию реакционной системы. В зависимости от того, одну или неколько фаз образуют реагенты и продукты реакции химические реакции делят на гомофазные или гетерофазные. Гомофазными называют реакции, в которых исходные реагенты, стабильные промежуточные продукты и продукты реакции находятся в пределах одной фазы. Гетерофазными называют реакции, в которых исходные реагенты, стабильные промежуточные продукты и продукты реакции образуют более, чем одну фазу.
2. По месту протекания реакции классифицируют на гетерогенные (протекают в объеме одной фазы) и гомогенные (протекают на поверхности раздела фаз).
Понятия «гомогенная» и «гетерогенная» реакции не совпадают с понятиями «гомофазный» и «гетерофазный» процессы. Гомогенность и гетероген-ность реакции отражает в определенной степени ее механизм: протекает ли реакция в объеме какой-то одной фазы или на поверхности раздела фаз. Гомофазность и гетерофазность процесса позволяют лишь судить о фазовом состав участников реакции.
Например, протекающий в растворе процесс нейтрализации кислоты щелочью – это гомофазный гомогенный процесс. Каталитический синтез аммиака – это гомофазный гетерогенный процесс. Окисление углеводородов в жидкой фазе газообразным кислородом – это гетерофазный процесс, но протекающая химическая реакция является гомогенной. Наконец, реакция получения гашеной извести
СаО + Н2О = Са(ОН)2, (5.1)
при которой все три участника процесса находятся в разных фазах, а реакция идет на границе раздела воды и оксида кальция, является гетерофазной, гетерогенной реакцией.
3. По механизму осуществления реакции различают простые (одностадийные) и сложные (многостадийные), в т.ч. параллельные, последовательные, параллельно-последовательные, обратимые, цепные, сопряженные.
Простыми называют реакции, осуществление которых связано с преодолением только одного энергетического барьера (одна стадия).
Сложные реакции включают в себя ряд параллельных и/или последовательных стадий (простых реакций).
В реальных условиях одностадийные реакции встречаются очень редко. Однако некоторые сложные реакции, проходящие через ряд промежуточных стадий, удобно считать формально простыми. Это возможно тогда, если промежуточные продукты реакции в условиях рассматриваемой задачи не обнаруживаются.
4. По обратимости реакции подразделяют на обратимые и необратимые.
5. По знаку теплового эффекта реакции делят на экзотермические, сопровождающиеся выделением теплоты (Q>0) и уменьшением энтальпии реакционной системы(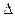 Н< 0) и эндотермические, протекающие с поглощением теплоты (Q < 0) и увеличением энтальпии реакционной системы(
Н< 0) и эндотермические, протекающие с поглощением теплоты (Q < 0) и увеличением энтальпии реакционной системы(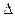 Н > 0).
Н > 0).
6. По наличию катализатора различают каталитические и некаталитические реакции.
7. По температуре проведения реакции классифицируют на низкотемпературные и высокотемпературные.
8. Классифицируя реакции по молекулярности, учитывают количество молекул, участвующих в элементарном акте реакции. Различают моно-, би- и тримолекулярные реакции.
9. По порядку реакцииклассифицируют по виду кинетического уравнения. Порядком реакции называют сумму показателей степени у концентраций регентов в кинетическом уравнении.
Графическое представление о технологической классификации химических реакций показано в таблица 5.1.
Таблица 5.1
| Признак классификации | Примеры химических реакций |
| 1. Механизм и химизм реакции: - простая необратимая - простая обратимая - - с неблагоприятным равновесием - сложная необратимая - параллельная предыдущей - последовательная (консекутивная) - сложная обратимая |
2KClO3 =2KCl + 3O2 SO2 + 0,5O2 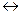 SO3
3H2 + N2 SO3
3H2 + N2 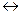 2NH3
NH3 + 1,25O2 = NO + 1,5H2O
2NH3 + 1,5O2 = N2 + 3H2O
С6Н5СН3 +О2 = С6Н5СН2ООН= С6Н5СНО +Н2О
СО + Н2О 2NH3
NH3 + 1,25O2 = NO + 1,5H2O
2NH3 + 1,5O2 = N2 + 3H2O
С6Н5СН3 +О2 = С6Н5СН2ООН= С6Н5СНО +Н2О
СО + Н2О 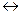 СО2 + Н2
СО + 2Н2 СО2 + Н2
СО + 2Н2 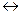 СН3ОН СН3ОН
|
| 2.Величина и знак теплового эффекта реакции: - сильноэкзотермическая - слабоэкзотермическая - сильноэндотермическая - слабоэндотермическая |
SO2 + 1,5O2 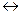 SO3 + 297 кДж/моль
С6Н12 SO3 + 297 кДж/моль
С6Н12 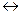 СН3(СН2)2СН=СН – СН3 +
циклогексан 2-гексен
59,9 кДж/моль
С6Н12 = С6Н6 + 3Н2 – 221 кДж/моль
ROH + R1COOH СН3(СН2)2СН=СН – СН3 +
циклогексан 2-гексен
59,9 кДж/моль
С6Н12 = С6Н6 + 3Н2 – 221 кДж/моль
ROH + R1COOH 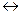 RCOOR1 + H2O – 50 кДж/моль RCOOR1 + H2O – 50 кДж/моль
|
| 3. Кинетическая модель–порядок реакции - нулевой - первый - второй - третий - дробный | Уравнение скорости реакции: – VA = k – VA = kCA – V = kCACB; – V = kC2A ; – V = kC2B – V = kC2ACB; – V = k CACB2 – V = kCACD1,5 |
| 4. Температура реакции: - высокотемпературная (более 500 оС) - среднетемпературная (160–500 оС) - низкотемпературная (менее 160 оС) | Пиролиз углеводородного сырья Окисление парафинов Алкилирование изобутана олефинами |
В таблице обозначено: А, В – исходные реагенты; V – скорость реакции; k – константа скорости; С – концентрация.
Дата публикования: 2015-10-09; Прочитано: 1133 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
