 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Лабораторная диагностика холеры
|
|
Знать:
1. Материал для исследования
2. Способы сбора материала
3. Основные методы исследования
4. Ход исследования с идентификацией чистой культуры
Уметь:
1. Провести забор исследуемого материала и доставка его в лабораторию
2. Провести регистрацию и кодирование исследуемого материала
3. Приготовление питательной среды для первичного посева и для изучения ферментативной активности
4. Выделение чистой культуры и провести ее идентификацию
Материал для исследования: испражнения, рвотные массы, секреторный материал, пищевые продукты, вода, смыв с объекта внешней среды.
Способы сбора материала:
1. Испражнения — последняя вышедшая порция после естественной дефекации. 10-20 мл переносят в стерильные стеклянные баночки с закрывающимися пробками. Сверху пробку обвязывают двойным слоем вощеной бумаги. Этикетируют баночки до внесения вних материала. Материал можно собирать резиновым катетером, ректальной петлей.
2. Рвотные массы — 10-15г. собирают стерильной ложечкой, перемещают в широкогорлую баночку.
3. Секреторный материал — отрезки верхней, средней, нижней части тонкого кишечника. Участки вырезают между двойничными лигатурами с содержимым, помещают в стерильную баночку.
При массовых обследованиях по эпидпоказаниям для выявления носительства можно делать групповые посевы. Материал от 4-5 обследуемых засевают в одну колбу с 100 мл с 1% пептонной водой. Исследования ведут как один анализ. При положительном ответе материал снова берут от этих обследуемых и исследуют индивидуально.
Для забора материала используют стерильную посуду, хорошо закрывающуюся крышками или пробирками, проверенная на целостность, заранее экитированную.
Забор проводят в спец. одежде: халат, резиновый фартук, резиновые перчатки, маска, шапочка.
После забора материала пробки посуды хорошо обвязывают вощеной бумагой, помещают в металлическую посуду — бикс, контейнер. Прилагается сопроводительный документ с указанием предполагаемого диагноза, времени и места взятия его, фамилия собиравшего материал.
Доставка в бак. лабораторию спец. транспортом в кратчайший срок.
В бак. лаборатории поступивший материал регистрируется, т. е. данные сопроводительного документа переносят в регистрационный журнал и под номером запись идет на дальнейшее исследование.
Методы исследования:
1. Бактериологический
2. Микроскопический
3. Серологический
4. Ускоренные методы диагностики:
а) реакция иммобилизации
б) РИФ
Исследование проводят поэтапно. Посевы на жидкие среды проводят через 6-8 часов, а на плотные через 12-18 часов. Бак. лаборатория переходит на круглосуточный режим работы.
Семейство: Vibrionaceae, род: Vibrio (холероподобные), вид: V. Cholerae, биовары: v. Коха, v. Эль-Тор.
Микроскопический метод: окраска по Граму и Цилю-Нильсену, фиксация смесью Никифорова 15-20 минут.
Экспресс-метод: метод иммобилизации с холерной сывороткой и холерными фагами. Ответ через 3-5 минут.
РИФ: ответ через 1-2 часа. Ярко-желтое свечение в виде блестящего ободка по периферии клетки.
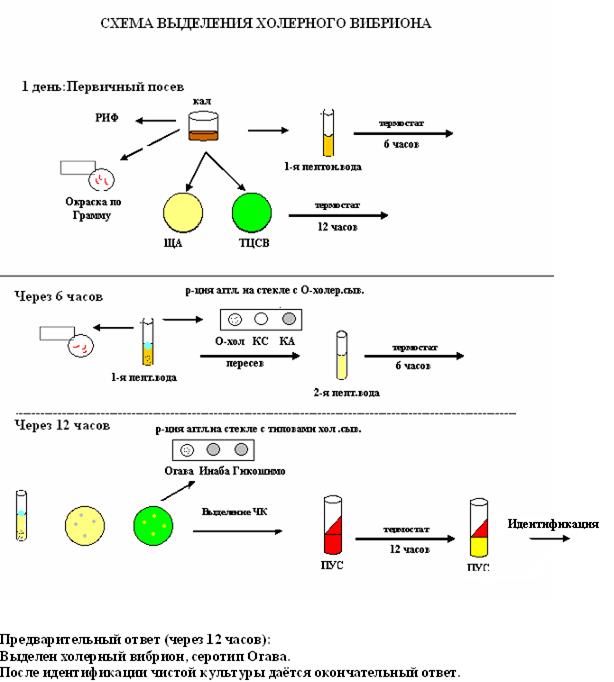
Бактериологический метод:
Первый этап:
1. Посев на 1% ПВ (с теллуритом К) из расчета 0,5-1 мл исследуемого материала на 50-100 1% ПВ.
2. Посев на плотные среды: TCBS, ЩА — петлей. Термостатирование при 37 градусах Цельсия.
Второй этап:
3. Через 6 часов изучение роста на ПВ — вибрионы формируют нежную голубоватую пленку.
4. Наличие вибрионов определяется микроскопически: из пленки готовят препараты, окрашиваем по Граму и Цилю-Нильсену — видим Гр- палочки в виде зяпятой, расположенные «стайкой рыб».
5. Предварительные тесты для дифференциации холерного вибриона от холероподобных: ОРА с OI — холерной сывороткой; реакция с поливалентным холерным фагом.
6. Пересев материала пленки на TCBS, ЩА и на II-ую ПВ при 37 градусах.
Третий этап:
7. Через 12-16 часов изучение роста на TCBS — колонии в S-форме, мелкие, желтые. На ЩА — в S-форме «капельки росы».
8. С подозрительными колониями ставятся тесты:
а) На оксидазу. На изолированную колонию наносим капли реактива и через 1-2 минуты колония синеет. Оксидаза присутствует у холерных вибрионов — у холероподобных отсутствует.
б) Постановка ОРА с IO — холерной сывороткой.
в) Постановка ОРА с типовыми сыворотками Огава, Инаба.
На основании положительной оксидазной пробы и ОРА, при микроскопии — Гр- палочки в виде запятой, выдается приблизительный ответ.
9. Подозрительные колонии пересеваются на полеуглеводную среду — ПУС для выделения чистой культуры.
Четвертый этап:
10. Через 12 часов изучение роста на ПУС: сахароза и лактоза расщепляется до кислоты.
11. Постановка с чистой культурой дифференцирующих тестов:
а) Тесты родо-видовой принадлежности (V.cholerae). Определение группы Хейберга — посев на маннозу, сахарозу, арабинозу. Учет через 14 часов: манноза, сахароза, арабиноза расщепляется до кислоты. Определение диастазы — посев на среду Кодама с крахмалом. Через 14 часов к среде добавить йод. Посинения не произойдет, т. к. диастаза разрушила крахмал. У холерных вибрионов диастаза присутствует.
б) Тесты для определения биовара. Определение гемолитических свойств: к 1 мл бульонной культуры добавить 1 мл 1% взвеси эритроцитов барана. Термостатирование 2 часа при 37 градусах Цельсия.
Учет:
Гемолизин положительно: в пробирке «лаковая кровь» - культура Эль-Тор.
Гемолизин отрицательно: в пробирке осадок эритроцитов, культура классического вибриона Коха.
Определение чувствительности к полимиксину: к питательной среде добавить 50 Ед на 1 мл среды. Посев исследуемой культуры. Учет через 8-10 часов.
Рост есть — культура не чувствительно к полимексину — биовар Эль-Тор.
Роста нет — культура чувствительна к полимексину — биовар Коха.
Реакция Фогеса-Проскауэра (RWP) посев на фосфатно-буферный бульон Кларка с глицерином. Через 2 суток к бульону добавить 0,6 мл А-нафтола и 0,2 мл 40% NaOH. Появление малинового окрашивания свидетельствует о накоплении в среде ацетилметилкарбинола. Малиновое окрашивание — Эль-Тор; отсутствие окрашивания — Коха.
Определение фаговара: используется чашка Петри с перегородкой. В оба сектора вносят щелочной агар и засевают исследуемую культуру. После подсушивания на один сектор наносят каплю фага с мукерджи IV типа, на другой сектор — фаг Эль-Тор. Учет через 14-16 часов. Если лизис культуры фагом с мукерджи IV типа наличие «стерильного пятна», то культура Коха. Если лизис культуры под влиянием фага Эль-Тор, то биовар Эль-Тор.
Питательные среды
1. 1% пептоновая вода — к 1 литру дистиллированной воды добавить 10 грамм пептона, 5 грамм NaCl, 0,1 грамма нитрата калия и карбонат натрия до установления pH 9,0. Разлить во флаконы, пробирки. Стерилизовать в автоклаве 20 минут при 120 градусах.
2. Щелочной агар — к 1 литру МПА добавить 30 мл 10% раствора карбоната натрия, кипятить 45 минут. Установить pH 8,0-9,0. Разлить во флаконы, пробирки. Стерилизовать в автоклаве 20 минут при 120 градусах.
3. Среда Кларка — 5 грамм двузамещенного фосфата калия, 5 грамм пептона, 5 грамм глюкозы. Растворить в 1 литре дистиллированной воды. Довести до кипения, профильтровать, разлить в пробирки. Стерилизовать при 0,5 атм. 30 минут.
4. Сестра TCBS — сухая среда — pH 8,6. Выпускается фирмой Дифко (США).
Дополнительные исследования:
1. Определение антигена возбудителя в исследуемом материале с помощью ДНК.
2. Серологический метод:
а) Выявление переболевших
б) Определение напряженности иммунитета у вакцинированных
Дата публикования: 2015-10-09; Прочитано: 5370 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
