 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Способы выражения концентраций и составов газообразных, жидких и твердых растворов и их смесей
|
|
Исходными реагентами, а также конечными продуктами могут быть вещества, находящиеся в твердом, жидком и газообразном состояниях. На практике используют различные способы выражения концентраций и составов, а также переход от одних единиц, характеризующих состав, к другим.
Для газообразных веществ масса их смеси определяется по формуле
 (1)
(1)
где 22,4 – объем (л или м3), который занимает 1 моль (кмоль) газа при нормальных условиях (Т = 273 K, Р = 101,3 кПа); V 1, V 2, …, Vi - объемы газообразных компонентов, л или м3; М1, М2, …, М i - молярные массы газообразных компонентов, г/моль или кг/кмоль.
Средняя молярная масса газовой смеси (при аддитавности ее свойств) равна
Мсмеси = (V 1 × М1 + V 2 × М2 + … + Vi × М i) / (V 1 + V 2 + … + Vi). (2)
Концентрацию компонентов газовых смесей выражают чаще всего в объемных долях (Vi / V смеси) или объемных процентах (Vi × 100 / V смеси). Объемная доля численно совпадает с молярной долей данного компонента.
Зависимость между давлением P, объемом V и температурой Т (K) вещества в газообразном состоянии определяется уравнением состояния газа (уравнением Менделеева – Клапейрона)
PV = n R T = (m / M) × R T, (3)
где n – химическое количество газа; М – молярная масса газа; R – универсальная газовая постоянная, равная 8,314 Дж/(моль · K).
Если газ находится при одних условиях (Р, Т) и необходимо определить его объем при других условиях (Р 1, Т 1) или массу, то используют следующие формулы:
1) для расчета объема
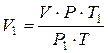 ; (4)
; (4)
2) для расчета массы
 (5)
(5)
где V н.у. – объем газа, приведенный к нормальным условиям; V – объем газа при заданных условиях.
Раствор – однородная система переменного состава, содержащая два и большее число компонентов. Компонент, взятый в избытке и в том же агрегатном состоянии, что и сам раствор, принято считать растворителем, а компонент, взятый в недостатке, – растворенным веществом.
В жидком состоянии реагенты и продукты чаще всего находятся в виде растворов.
Для растворов необходимо знать их количественный состав, который может выражаться следующими способами:
- массовая доля растворенного вещества А (w(А));
- молярная концентрация С (А), моль/л.
- молярная концентрация эквивалента С (1/ z (А)), моль-экв/л.
- молярная доля растворенного вещества N (А).
Массовая доля растворенного вещества w(А) – это величина, равная отношению массы вещества m А к массе раствора m р-ра.
w(А) = m А / m р-ра, (6)
где m р-ра = m А + m растворителя.
Массовую долю выражают в долях единицы или в процентах.
Молярная концентрация равна отношению химического количества растворенного вещества (n (А), моль) к объему раствора (V, л).
С (А) = n (А) / V. (7)
Химическое количество вещества выражается соотношением
n (А) = m (А) / М(А), (8)
где m (А) – масса вещества А, г, кг; М(А) – молярная масса вещества А, г/моль, кг/кмоль.
Если известна масса m и плотность r раствора, то его объем V рассчитывается по формуле
V = m р-ра / r. (9)
Молярная концентрация эквивалента (нормальная концентрация) С (1/ z (А)) равна отношению химического количества вещества эквивалента (n экв(А), моль) к объему раствора (V, л).
С (1/ z (А)) = n экв(А) / V. (10)
Химическое количество вещества эквивалента выражается соотношением
n экв(А) = m (А) / М(1/ z (А)). (11)
Молярная доля растворенного вещества N (А) - это величина, равная отношению химического количества растворенного вещества к общему числу моль всех веществ в растворе.
N (А) = n (А) / å ni. (12)
Молярная доля выражается в долях единицы или в процентах (моль %).
Расчеты при разбавлении и смешении двух растворов удобно производить с помощью так называемого правила креста, наглядное представление о котором дает приведенная ниже схема:
С 1 (С - С 2)
 | |||
 | |||

 С
С
С 2 (С 1 - С)
В точке С пересечения прямых записывают содержание вещества в смешанном растворе С (%). Содержание веществ в исходных смешиваемых растворах С 1 и С 2 (%) указывают с левой стороны креста, причем С 1 > С 2. Разность С 1 - С соответствует количеству массовых частей С 2%-ного раствора, необходимого для смешения с С - С 2 частями С 1%-ного разбавляемого раствора. При разбавлении раствора водой С 2 = 0.
В химической промышленности широкое распространение получили процессы с использованием твердых веществ. Их состав чаще всего выражается:
1) в массовых долях (mi / m смеси) или массовых процентах (m i · 100 / m смеси);
2) в молярных долях (рассчитывается по формуле (12)).
Дата публикования: 2015-10-09; Прочитано: 1429 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
