 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Пример 1. Сожжено 100 м3 газовой смеси, содержащей 50 об
|
|
Сожжено 100 м3 газовой смеси, содержащей 50 об. % пропана и 50 об. % бутана. Избыток воздуха по отношению к теоретически необходимому для сгорания составляет 20%. Составить материальный баланс процесса горения и рассчитать состав продуктов сгорания (об. %).
Решение.
При расчете принимаем, что воздух является смесью одного объема кислорода и 3,76 объема азота (т. е. молярное отношение О2: N2 составляет 1: 3,76). Объем 1 кмоль О2, N2 при н. у. равен 22,4 м3.
Уравнения реакций горения имеют следующий вид:
С3Н8 + 5О2 = 3СО2 + 4Н2О;
С4Н10 + 6,5О2 = 4СО2 + 5Н2О.
Исходя из состава воздуха и с учетом его избытка при сжигании газовой смеси, запишем общее уравнение реакции, принимая во внимание, что молярное соотношение пропана и бутана в смеси такое же,
как объемное соотношение (т. е. 1: 1):
воздух для воздух для избыток воздуха
сжигания пропана сжигания бутана
 |  |  | |||
С3Н8 + 5О2 + 18,8N2 + С4Н10 + 6,5О2 + 24,4N2 + 0,2(11,5О2 + 43,2N2) =
= 7CО2 + 9Н2О + 43,2N2 + 2,3О2 + 8,7N2.
Данное уравнение можно записать в следующем виде:
С3Н8 + С4Н10 + 13,8О2 + 51,9N2 = 7CО2 + 9Н2О + 2,3О2 + 51,9N2.
Результаты материального баланса представлены в табл. 1. Стехиометрические балансы могут быть представлены в виде уравнений, согласно которым можно рассчитать степень превращения реагентов и их концентрацию в данный момент времени (табл. 2).
Так, например, общий вид уравнения реакции
ên а çА + ên b çВ + … + ên i çI + ên j çJ + ên k çK… = ên r çR + ên s çS, (31)
где n - стехиометрический коэффициент; ên ç - абсолютное значение стехиометрического коэффициента (для исходных веществ n < 0, для продуктов n > 0).
Обозначим количество исходных веществ (в моль) перед началом реакции через na 0, nb 0, …, ni 0, …, а количество исходных веществ в данный момент реакции na, nb, …, ni, …. Когда исходные реагенты берутся в стехиометрическом соотношении, степени превращения каждого из них одинаковы. Если же исходные реагенты вступают в реакции не в стехиометрическом соотношении, то значение степени превращения х зависит от того, для какого вещества эта величина рассчитывается. Следовательно, так как соотношения количеств исходных реагентов могут быть нестехиометрическими, расчет будем вести по степени превращения одного, произвольно выбранного, исходного реагента, например K.
хk =  .
.
В соответствии со стехиометрическим уравнением (31), когда превращению подвергается 1 моль исходного вещества K, одновременно превращение претерпевает число молей исходного вещества I, равное
ni 0 - ni = 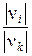 × nk 0 × хk.
× nk 0 × хk.
Мгновенное значение концентрации исходного вещества J (мольной доли Nj) равно отношению числа молей J, содержащихся в данный момент в системе, реагирующей согласно уравнению (31), к числу всех молей, находящихся в данный момент в системе (сумма в четвертой графе табл. 2):
Nj =  . (32)
. (32)
В числителе и знаменателе выражения (32) написан знак «+», так как вместо ên i ç использовано n i (для исходных веществ n i < 0).
Разделив числитель и знаменатель правой части уравнения (32) на сумму чисел молей введенных исходных веществ  (сумма во втором столбце табл. 2) и приняв во внимание, что
(сумма во втором столбце табл. 2) и приняв во внимание, что
Nj 0 = 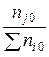 или Nk 0 =
или Nk 0 =  ,
,
получим зависимость молярной доли Nj исходного вещества J от молярных долей компонентов исходной смеси:
Nj =  . (33)
. (33)
Когда известен состав исходной смеси, можно с помощью выведенного уравнения быстро рассчитать концентрацию каждого исходного вещества, которая соответствует данной, отнесенной к одному из реагентов (K) степени превращения хk.
Мольная доля Nj равна объемной доле, если в реакции участвуют газы, свойства которых близки к свойствам идеального газа, следовательно, в этом случае уравнение (33) можно использовать и для расчета объема реагирующих газов.
Если известен состав смеси вводимых в реакцию исходных веществ и аналитически определена мольная доля одного из компонентов в некоторый момент времени, можно рассчитать для этого момента значение степени превращения, отнесенное к указанному компоненту. После преобразования уравнения (33) степень превращения хk будет равна
хk =  . (34)
. (34)
В случае одновременного протекания двух параллельных реакций, например
 ,
,
 ,
,
аналогично уравнению (33) получается
 . (35)
. (35)
Дата публикования: 2015-10-09; Прочитано: 1020 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
