 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Кинетика - это раздел химии, изучающий скорость, механизм химических реакций и влияние на них различных факторов
|
|
Очевидно, что достаточно сложные молекулы могут превращаться в целый набор различных продуктов. Например, этиловый спирт способен давать олефин, эфир, альдегид, кикислоту, дивинил. Понятно, что скорости этих процессов и вероятность преимущественного получения какого-либо продукта зависят от условий опытов, различных воздействий на систему, в частности, от присутствия катализатора, облучения.
Рассмотрение механизмов химических превращений, изучение влияния на них и на скорость превращения внутренних и внешних параметров и есть предмет химической кинетики. Достаточно условно можно разделить предмет статистически равновесной химической кинетики на три основных раздела:
-феноменологическая (формальная) кинетика. (Описание зависимости скорости реакции от времени, температуры и количества участвующих в превращении веществ, а также и других внешних воздействий на основе предполагаемой кинетической схемы).
-теоретическая кинетика или химическая физика. (Вычисление значений констант скоростей и энергий активации реакции с использование молекулярных постоянных на основе теории строения молекул и статистической физики).
-макрокинетика.( Описание закономерностей протекания химических процессов при тепло - и массопереносе).
Скорость химической реакции — изменение количества одного из реагирующих веществ за единицу времени в единице реакционного пространства. Является ключевым понятием химической кинетики. Скорость химической реакции — величина всегда положительная, поэтому, если она определяется по исходному веществу, то полученное значение умножается на −1.
Кроме концентрации на скорость химической реакции оказывают влияние следующие факторы:
· природа реагирующих веществ,
· наличие катализатора,
· температура (правило Вант-Гоффа),
· давление,
· площадь поверхности реагирующих веществ.
Выражают в моль/л-с. Различают среднюю скорость реакции в интервале времени 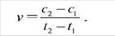 и истинную скорость реакции в определенный момент времени(графически).
и истинную скорость реакции в определенный момент времени(графически).
Константа скорости реакции (удельная скорость реакции) — коэффициент пропорциональности в кинетическом уравнении. Константа скорости реакции зависит от температуры, от природы реагирующих веществ, от катализатора, но не зависит от их концентрации.
Правило Вант-Гоффа — эмпирическое правило, позволяющее в первом приближении оценить влияние температуры на скорость химической реакции в небольшом температурном интервале (обычно от 0 °C до 100 °C). При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в 2-4 раза.
Уравнение, которое описывает это правило, следующее:

где 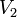 — скорость реакции при температуре
— скорость реакции при температуре 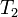 ,
,  — скорость реакции при температуре
— скорость реакции при температуре 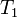 ,
, 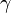 — температурный коэффициент реакции.
— температурный коэффициент реакции.

5. Растворы. Способы выражения состава растворов. Физическая, химическая и современная теории растворов.
Раство́р — гомогенная (однородная) смесь, состоящая из двух или более компонентов, состав которых может изменяться непрерывно в некоторых пределах без скачкообразного изменения её свойств.
Бывают: твердые(сплавы, полупроводники..), жидкие(соли, кислоты, щелочи), газообразные(газовые смеси (воздух)).
Состоят из растворителя(компонент, который преобладает и кристаллизуется первым при охлаждении) и растворенного вещества(может быть несколько).
Состав раствора –описывается с помощью концентрации:
- Молярная к. –число молей вещества в 1л.
- Нормальная к. –число молей эквивалентов раств-го вещества в 1л.
- Моляльная к. – количество раств-го вещества в 1кг растворителя.
- Процентная к. - сколько растворённого вещества содержится в каждых 100 единицах массы (г, кг) раствора.
Физическая теория растворов:
Основоположенниками были Вант Гофф, Оствальд, Лррениус, - рассматривает процесс растворения распределения частиц растворенного вещества между частицами растворителя, при отсутствии какого-либо взаимодействия между ними.
Движущая сила-увеличение энтропии системя DS.
Отсутсвие тепловых и объемных эффектов (DН=0, DV=0)
Химическая теория вещества растворов:
В противоположность физической теории растворов — Д.И. Менделеев доказывал, что процесс растворения – это образование смесей не устойчивых к химическим соединениям.
Сопровождаются тепловым эффектом DН и изменением объема системы.
Современная физико-химическая теория растворов:
Ее предсказывал еще в 1906 г. Д. И. Менделеев, которую он описал в своем учебнике «Основы химии».- изменение свойств растворителя и растворенного вещества, что обусловлено взаимодействием частиц между собой. (Ван-дер-Ваальсового, ион-дипольного).
Чем больше концентрация, тем интенсивнее взаимодействие частиц, тем сложнее структура раствора.
Процесс растворения – взаимодействие частиц разной полярности.
Вода является хорошим полярным растворителем.
6. Коллигативные свойства растворов. Понижение давления насыщенного пара над раствором. Температура замерзания разбавленных растворов. Температура кипения разбавленных растворов. Осмос. Осмотическое давление разбавленных растворов.
Коллигативные свойства растворов — это свойства растворов, обусловленные только самопроизвольным движением молекул, то есть они определяются не химическим составом, а числом кинетических единиц — молекул в единице объёма или массы[1]. К таким коллигативным свойствам относятся:
· Понижение давления насыщенного пара,
· Повышение температуры кипения растворов (разбавленных)– т.кипения растворов нелетучего вещества всегда выше т.кипения чистого растворителя.
· Понижение температуры замерзания растворов(разбавленных) – т.замерзания раствора нелетучего вещества всегда ниже т.кристализации чистого растворителя.
· Возникновение осмотического давления – давление которое нужно приложить к раствору, чтобы задержать перемещение растворителя через мембрану, разделяющую растворы с разной концентрацией.
Растворы с одинаковым осмотическим давлением называются изотоническими.
Осмос - процесс односторонней диффузии через полупроницаемую мембрану молекул растворителя в сторону бо́льшей концентрации растворённого вещества из объёма с меньшей концентрацией растворенного вещества.
Играет важную роль в биологических процессах, участвует в переносе питательных веществ, для получения некоторых полимеров и очистки воду.
Пар, находящийся в равновесии с жидкостью, называют насыщенным. Давление такого пара над чистым растворителем (p0) называют давлением насыщенного пара чистого растворителя.
Франсуа Мари Рауль
В 1886 (1887) году Ф. М. Рауль сформулировал закон:
«Давление пара раствора, содержащего нелетучее растворенное вещество, прямо пропорционально мольной доле растворителя в данном растворе»:
p = p0 · χр-ль, где
p — давление пара над раствором, Па;
p0 — давление пара над чистым растворителем;
χр-ль —— мольная доля растворителя.
7. Теория электролитической диссоциации Аррениуса. Растворы электролитов и неэлектролитов. Слабые и сильные электролиты. Степень и константа диссоциации, их зависимость от концентрации и температуры.
Электролитическая диссоциация — процесс распада электролита на ионы при его растворении или плавлении. Теория электролитической диссоциации была предложена Аррениусом (1884-1887), Основные положения теории Аррениуса:
1. Соли, кислоты, основания при растворении в воде и некоторых других полярных растворителях частично или полностью распадаются (диссоциируют) на ионы. Эти ионы существуют в растворе независимо от того, проходит через раствор электрический ток или нет. Вследствие этого число независимо движущихся частиц растворенного вещества больше, чем при отсутствии диссоциации, а величины коллигативных свойств растворов возрастают прямо пропорционально числу частиц. Ионы представляют собой заряженные частицы, которые состоят или из отдельных атомов, или из группы атомов. Предполагается, что ионы в растворе ведут себя подобно молекулам идеального газа, то есть не взаимодействуют друг с другом.
2. Наряду с процессом диссоциации в растворе идет обратный процесс - ассоциация ионов в молекулы. Таким образом, диссоциация молекул на ионы является неполной, поэтому в качестве меры электролитической диссоциации Аррениус ввел величину степени диссоциации a, определяемую как долю молекул, распавшихся на ионы
3. Диссоциация растворенных веществ на ионы подчиняется тем же законам химического равновесия, что и другие реакции, в частности, закону действующих масс.
РАСТВОРЫ ЭЛЕКТРОЛИТОВ содержат в заметных концентрациях ионы-катионы и анионы, образующиеся в результате электролитической диссоциации молекул растворенного в-ва. Растворитель (чистый или смешанный) обычно в сколько нибудь значительной степени не диссоциирован.
Р. э. обладают способностью проводить электрический ток и относятся к проводникам второго рода. Благодаря увеличению общего числа частиц коллигативные свойства бесконечно разбавленных Р. э. (т. е. св-ва, зависящие только от концентрациирастворенного вещества, но не от его природы) существенно отличаются от тех же свойств растворов неэлектролитов.
Этим, в частности, объясняется увеличение осмотич. давления в сравнении созначением, предсказывамым законом Вантфа (см. Осмос),понижение давления пара растворителя над раствором в сравнении с предсказываемым Рауля законом и др.
Наличием ионов обусловлены также классификация Р. э., особенности теоретических подходов в сравнении с другими классами растворов. Наиболее изучены водные Р. э., играющие важную роль во многих биол., геол. и техн. процессах. Неводные Р. э. служат средойдля проведения синтеза и электрохим. процессов, используются в совр. технологиях (создание новых химических источников тока, солнечных батарей, процессы разделения веществ и др.).
Растворы НЕЭЛЕКТРОЛИТОВ, бинарные или многокомпонентные мол. системы, состав которых может изменяться непрерывным образом (по крайней мере, в некоторых пределах). В отличие от растворов электролитов, в растворах неэлектролитов (молекулярных р-рах) заряженные частицы в сколько-нибудь заметных концентрациях отсутствуют. Растворы неэлектролитов могут быть твердыми, жидкими и газообразными. Растворы неэлектролитов служат средой, в которой протекают многие прир. и пром. процессы. Изучение и прогнозирование свойств этих систем тесно связаны с такими практич. проблемами, как подбор р-рителей для реализации технол. процессов, получение систем с заданными св-вами, разделение прир. и пром. смесей (включаягазы и нефти), глубокая очистка веществ.
Слабые электролиты — химические соединения, молекулы которых даже в сильно разбавленных растворах незначительно диссоциированны на ионы, которые находятся в динамическом равновесии с недиссоциированными молекулами. К слабым электролитам относится большинство органических кислот и многие органические основания в водных и неводных растворах.
Слабыми электролитами являются:
· почти все органические кислоты и вода;
· некоторые неорганические кислоты: HF, HClO, HClO2, HNO2, HCN, H2S, HBrO, H2CO3, H2SiO3, H2SO3 и др.;
· некоторые малорастворимые гидроксиды металлов: Fe(OH)3, Zn(OH)2 и др.
Сильные электролиты — химические соединения, молекулы которых в разбавленных растворах практически полностью диссоциированы на ионы. Степень диссоциации таких электролитов близка к 1. К сильным электролитам относятся многие неорганические соли, некоторые неорганические кислоты и основания в водных растворах, а также в растворителях, обладающих высокой диссоциирующей способностью (спирты, амиды и др.).
Классическая теория электролитической диссоциации применима лишь к разбавленным растворам слабых электролитов.Сильные электролиты в разбавленных растворах диссоциированы практически полностью, поэтому представления о равновесии между ионами и недиссоциированными молекулами лишено смысла. В сравнительно разбавленных растворах сильных электролитов равновесие между отдельными сольватированными ионами и ионными парами может быть приближённо охарактеризовано, аналогично классической теории электролитической диссоциации, константой диссоциации (или обратной величиной — константой ассоциации). Это позволяет использовать вышеприведённое уравнение для расчёта соответствующей степени диссоциации, исходя из экспериментальных данных.
В простейших случаях (большие одноатомные однозарядные ионы) приближённые значения константы диссоциации в разбавленных растворах сильных электролитов можно вычислить теоретически, исходя из представлений о чисто электростатическом взаимодействии между ионами в непрерывной среде — растворителе.Примеры сильных электролитов: некоторые кислоты (HClO4, HMnO4, H2SO4, HCl, HBr; HI), гидроксиды щелочных ищёлочноземельных металлов (NaOH, KOH, Ba(OH)2); большинство солей.
Константа диссоциации — вид константы равновесия, которая характеризует склонность объекта диссоциировать(разделяться) обратимым образом на частицы, как, например, когда комплекс распадается на составляющие молекулы, или когда соль диссоциирует в водном растворе на ионы. Константа диссоциации зависит только от температуры, но не зависит от концентрации раствора.
Степень диссоциации — величина, характеризующая состояние равновесия в реакции диссоциации в гомогенных (однородных) системах.
Степень диссоциации, в отличие от константы диссоциации, зависит от концентрации. Чем меньше концентрация, тем выше значение а. Эта зависимость выполняется для всех электролитов (сильных и слабых), имеющих молекулярное строение. Степень диссоциации ионных электролитов от концентрации не зависит, т.к. для них всегда она = 1.
8. Поверхностные явления на границе раздела фаз. Адсорбция и абсорбция. Поверхностная энергия. Физическая и химическая адсорбция. Адсорбция и её биологическое значение.
Пове́рхностные явле́ния — совокупность явлений, обусловленных особыми свойствами тонких слоёв вещества на границе соприкосновения фаз. К поверхностным явлениям относятся процессы, происходящие на границе раздела фаз, в межфазном поверхностном слое и возникающие в результате взаимодействия сопряжённых фаз.
Поверхностные явления обусловлены тем, что в поверхностных слоях на межфазных границах вследствие различного состава и строения соприкасающихся фаз и соответственно из-за различия в связях поверхностных атомов и молекул со стороны разных фаз существует ненасыщенное поле межатомных, межмолекулярных сил. Вследствие этого атомы и молекулы в поверхностных слоях образуют особую структуру, а вещество принимает особое состояние, отличающееся от его состояния в объеме фаз различными свойствами. Поверхностные явления изучаются коллоидной химией. Закономерности протекания поверхностных явлений, в частности структурообразования, служат теоретической основой получения материалов с заданными свойствами: керамики, цементов, ситаллов, сорбентов, катализаторов, полимеров, порохов, лекарственных средств и т. п.
Адсорбция — увеличение концентрации растворенного вещества у поверхности раздела двух фаз (твердая фаза-жидкость, конденсированная фаза - газ) вследствие нескомпенсированности сил межмолекулярного взаимодействия на разделе фаз. Адсорбция является частным случаем сорбции, процесс, обратный адсорбции – десорбция. Поглощаемое вещество, ещё находящееся в объёме фазы, называют адсорбтив, поглощённое — адсорбат. В более узком смысле под адсорбцией часто понимают поглощение примеси из газа или жидкости твёрдым веществом (в случае газа и жидкости) или жидкостью (в случае газа) — адсорбентом. При этом, как и в общем случае адсорбции, происходит концентрирование примеси на границе раздела адсорбент-жидкость либо адсорбент-газ. Процесс, обратный адсорбции, то есть перенос вещества с поверхности раздела фаз в объём фазы, называется десорбция. Если скорости адсорбции и десорбции равны, то говорят об установлении адсорбционного равновесия. В состоянии равновесия количество адсорбированных молекул остается постоянным сколь угодно долго, если неизменны внешние условия (давление, температура и состав системы).
Абсо́рбция — поглощение сорбата всем объёмом сорбента. Является частным случаем сорбции. Часто в процессе абсорбции происходит не только увеличение массы абсорбирующего материала, но и существенное увеличение его объема (набухание), а также изменение его физических характеристик – вплоть до агрегатного состояния.
На практике абсорбция чаще всего применяется для разделения смесей, состоящих из веществ, имеющих различную способность к поглощению подходящими абсорбентами. При этом целевыми продуктами могут быть как абсорбировавшиеся, так и не абсорбировавшиеся компоненты смесей.
Обычно в случае физической абсорбции абсорбировавшиеся вещества могут быть вновь извлечены из абсорбента посредством его нагревания, разбавления неабсорбирущей жидкостью или иными подходящими способами. Регенерация химически абсорбированных веществ также иногда возможна. Она может быть основана на химическом или термическом разложении продуктов химической абсорбции с высвобождением всех или некоторых из абсорбированных веществ. Но во многих случаях регенерация химически абсорбированных веществ и химических абсорбентов бывает невозможной или технологически/экономически нецелесообразной.
Явления абсорбции широко распространены не только в промышленности, но и в природе (пример - набухание семян), а также в быту. При этом они могут приносить как пользу, так и вред (например, физическая абсорбция атмосферной влаги приводит к набуханию и последующему расслоению деревянных изделий, химическая абсорбция кислорода резиной - к потере ею эластичности и растрескиванию).
Различают физическую абсорбцию и хемосорбцию.
При физической абсорбции процесс поглощения не сопровождается химической реакцией.
При хемосорбции абсорбируемый компонент вступает в химическую реакцию с веществом абсорбента.
Поверхностная энергия - энергия, сосредоточенная на границе раздела фаз, избыточная по сравнению с энергией в объеме. При увеличении поверхности раздела фаз удельная полная поверхностная энергия (на единицу поверхности) e характеризует увеличение энергии системы. Она равна сумме механической работы s образования единицы площади поверхности и поглощаемой при этом теплоты q. B обратимом изотермическом процессе  , где Т -абсолютная температура, —
, где Т -абсолютная температура, —  -удельная поверхностная энтропия (связанная энергия). Обычно, говоря о поверхностная энергия, имеют в виду удельную свободную поверхностная энергия s. С ростом температуры вдали от критической точки s линейно уменьшается, тогда как e практически от температуры не зависит.
-удельная поверхностная энтропия (связанная энергия). Обычно, говоря о поверхностная энергия, имеют в виду удельную свободную поверхностная энергия s. С ростом температуры вдали от критической точки s линейно уменьшается, тогда как e практически от температуры не зависит.
При приближении к критической точке различие в свойствах контактирующих фаз сглаживается и поверхностная энергия обращается в нуль (см. Критическое состояние). Термин "поверхностная энергия" применяют обычно для границы твердое тело-газ (пар); если граничащие фазы суть твердое тело и жидкость или две несмешивающиеся жидкости, пользуются термином "межфазная энергия".
поверхностная энергия в значительной степени определяет форму кристаллов, работу образования новой фазы, прочность твердых тел, поверхностные явления, капиллярные явления, устойчивость дисперсных систем и др.
Физическая адсорбция обусловлена силами межмолеку-лярного взаимодействия Ван-дер-Ваальса, не избирательна, полностью обратима, протекает с высокой скоростью и имеет сравнительно низкую теплоту адсорбции — от нескольких килоджоулей до нескольких десятков килоджоулей на моль адсорбата. Адсорбция протекает молекулярно, т. е. преимущественно адсорбируются соединения в недиссоциированном состоянии. Физическая адсорбция характерна для веществ, адсорбируемых из парогазовой фазы, а при адсорбции из растворов осложнена физико-химическим взаимодействием адсорбата, адсорбтива и адсорбента.
Химическая адсорбция. На поверхности раздела двух фаз помимо адсорбции, обусловленной в основном физическими взаимодействиями (главным образом это Ван-дер-Ваальсовы силы), может идти химическая реакция. Этот процесс называется хемосорбцией. Чёткое разделение на адсорбцию и хемосорбцию не всегда возможно. Одним из основных параметров по которым различаются эти явления является тепловой эффект: так, тепловой эффект физической адсорбции обычно близок к теплоте сжижения адсорбата, тепловой эффект хемосорбции значительно выше. Кроме того в отличие от адсорбции хемосорбция обычно является необратимой и локализованной. Примером промежуточных вариантов, сочетающих черты и адсорбции и хемосорбции является взаимодействие кислорода на металлах и водорода на никеле: при низких температурах они адсорбируются по законам физической адсорбции, но при повышении температуры начинает протекать хемосорбция.
Адсорбцию применяют для глубокой очистки сточных вод от растворенных органических веществ после биохимической очистки, а также в локальных установках, если эти вещества биологически не разлагаются или являются сильно токсичными при небольшой их концентрации.
9. Общая характеристика дисперсных систем. Их классификация и распространение в природе. Методы получения коллоидных систем.
Диспе́рсная систе́ма — это образования из двух или большего числа фаз (тел), которые практически не смешиваются и не реагируют друг с другом химически. Первое из веществ (дисперсная фаза) мелко распределено во втором (дисперсионная среда). Если фаз несколько, их можно отделить друг от друга физическим способом (центрифугировать, сепарировать и т. д.).
Обычно дисперсные системы — это коллоидные растворы, золи. К дисперсным системам относят также случай твёрдой дисперсной среды, в которой находится дисперсная фаза.
Вся природа – организмы животных и растений, гидросфера и атмосфера…- представляют собой сложную систему совокупности множества грубодисперсных и коллоидно-дисперсных систем.
Дисперсное состояние универсально, при соответствующих условиях в него может перейти любое тело.
Классификация по раздробленности:
| Грубодисперсные и микрогетерогенные | Коллоидные (ультромикрогетерогенные) | Молекулярные и ионные (истинные) |
| 10-4-10-7 м | 10-7-10-9 м (1-100нм) | Менее 10-9м |
| Взвесь эритроцитов микроорганизмов, глина | Туман, молоко, желе, майонез, жемчуг | Растворы кислот, оснований, солей |
| гетерогенные | гетерогенные | гомогенные |
| Частицы виднны в оптический микроскоп | Видны в электронный или ультрамикроскоп | Не видны в современный микроскоп |
| Неустойчивы кинетическки и термодинамически | Относительно устойчивы кинетически | Устойчивы кинетически и термодинамически |
| Быстро оседают и стареют | Заметно не оседают, стареют со временем | Не оседают, не стареют |
| Непрозрачны (отражают свет) | Прозрачные опалисцируют (рассеивают свет) | Прозрачные (не опалисцируют) |
| Частицы не проходят через бумажный фильтр | Частицы задерживаются только ультрафильтрами | Спокойно проходят сквозь фильтр |
По агрегатному состоянию:
| среда | Дисперсная фаза | ||
| газ | жидкость | Твердая | |
| Газ | Коллоидная система не образуется | Туман, облако, жид.аэрозоли. | Д ым, пыль, тв.аэрозоли, космич.пыль. |
| Жидкость | Пены, газовые эмульсии | Эмульсии, молоко, нефть, сливочное масло | Суспензии. пасты, краски, латекс |
| твердая | тв.пены, пенопласты, селикагель, пенобетон, лава. | Жемчуг, опал, почва, вода в граните. | Цв.стекла, сплавы, пигментированные волокна. |
2 группы:
Дата публикования: 2015-10-09; Прочитано: 1179 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
