 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Закон действующих масс
|
|
Впервые зависимость направления химического процесса от концентрации реагирующих веществ установил Бекетов в 1865 году на основании экспериментов. В матем-ой форме закон был сформулирован только в 1867 году. Рассмотрим кинетический вывод закона действующих масс на примере гомогенной системы: aB+bB=rR+Ss
Скорость прямой реакции пропорциональна концентрации реагирующих в-в:
w1=k1CaA*CbB
скорость обратной реакции пропорциональна концентрации продуктов р-ии: w2=k2CrR*CsS
Из условия равенства следует, что скорость прямой р-ии равна скорости обратной р-ии:
w1=w2→k1CaA* CbB= k2CrR*CsS→  =
= 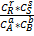 =Kc
=Kc
константа равновесия выражает з.д.м.:изменение концентрации одного из участников р-ции вызовет такие изменения концентрации всех остальных участников, т.о., что константа равновесия сохранит свое числовое значение при постоянной температуре и давлении. Константа равновесия может быть выражена через молярные концентрации, парциальные давления и молярные доли.
Дата публикования: 2015-10-09; Прочитано: 206 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
