 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Общие закономерности каталитических процессов
|
|
Каталитические реакции подчиняются общим законам химии и термодинамики, но имеют при этом свои особенности, так как в них всегда участвует один дополнительный компонент - катализатор. Действие катализаторов принципиально отличается от действия других факторов, способствующих интенсификации химических реакций, например, температуры, давления, радиационного воздействия и др. Повышение температуры может ускорять реакцию вследствие увеличения энергетического уровня реагирующих молекул, т. е. их активации за счет вводимого извне тепла. При этом изменяется внутренняя энергия системы и смещается положение равновесия. Катализатор же не влияет ни на равновесие химической реакции, ни на все другие термодинамические характеристики реакций. Изменяя в равной степени скорость прямой и обратной реакций, катализатор способствует повышению скорости достижения равновесия при данных условиях.
Теория каталитических процессов относится к числу сложных и недостаточно полно изученных областей современной физической Химии. В настоящее время еще нет общей теории, позволяющей предвидеть каталитическое действие различных веществ на ту или иную химическую реакцию. Существует несколько теорий, объясняющих механизм действия катализаторов, из которых наиболее распространенной теорией, служащей основой современных представлений о катализе, является теория промежуточных соединений.
Согласно этой теории, медленную реакцию между исходными веществами можно заменить двумя или несколькими более быстрыми реакциями' с участием катализатора, который образует с исходными веществами промежуточные непрочные соединения. Ускоряющее действие катализатора состоит в понижении энергии активации реакций образующихся промежуточных соединений, что оказывает очень сильное влияние на скорость реакции, поскольку в уравнение Аррениуса:
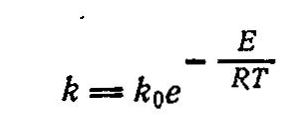
энергия активации Е входит в показатель степени.
При практическом применении большое значение имеет технологическая характеристика промышленных катализаторов (активность, температура зажигания, производительность, селективность, отравляемость, прочность и др.).
Наиболее важной характеристикой катализаторов является их активность, т. е. мера ускоряющего действия катализатора по отношению к данной реакции. Активность определяется уравнением:
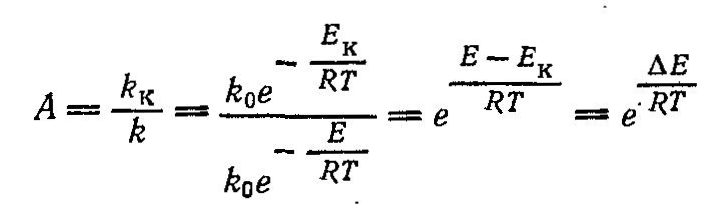
где А - активность катализатора;
k, kk - константы скорости реакцнн без катализатора и в присутствии катализатора;
∆Е - снижение энергии активации под действием катализатора:

Е, ЕК - энергия активации реакции без катализатора и в присутствии катализатора.
Температурой зажигания катализатора называют минимальную температуру реагирующей смеси, при которой процесс начинает протекать с достаточной для практических целей скоростью. Чем активнее катализатор, тем ниже температура зажигания, что особенно важно при проведении экзотермических обратимых реакций, так как при этом соответственно повышается степень превращения.
Отравление катализатора - это частичная или полная потеря его активности в результате действия посторонних примесей контактных ядов. Отравление может быть обратимым и необратимым. При обратимом отравлении примеси снижают активность катализатора временно, пока они присутствуют в зоне катализа; по удалении ядов катализатор восстанавливает свою прежнюю активность. При необратимом отравлении активность катализатора не восстанавливается и после удаления контактных ядов из зоны реакции.
Активность твердого катализатора может снижаться также вследствие уменьшения активной поверхности катализатора под воздействием, например, высоких температур, при осаждении на поверхности катализатора продуктов реакции или пыли, механического разрушения катализатора и по многим другим причинам.
Важной особенностью катализаторов является их избирательность (селективность) по отношению к определенным реакциям. В сложных реакциях (параллельных и последовательных), где термодинамически возможно образование нескольких продуктов, катализатор позволяет ускорить только одну целевую реакцию; естественно, что это имеет большое практическое значение.
Для сложной реакции типа
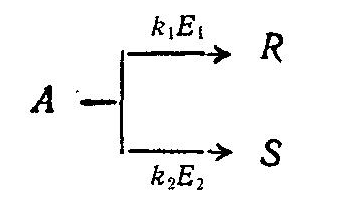
селективность выражается уравнением:

Из этого уравнения видно, что при некоторой заданной температуре Т путем подбора соответствующего катализатора можно изменять разность Е2 – Е1 и, таким образом, создавать возможности для получения только или главным образом целевого продукта.
Особенно сильно селективность проявляется в сложных органических реакциях. Следовательно, применяя соответствующий катализатор, из одного и того же сырья можно получить различные целевые продукты.В присутствии катализатора обычно снижается порядок реакции, причем, чем активнее катализатор, тем этот эффект сказывается сильнее, т. е. тем ниже порядок реакции. В связи с этим, кинетика каталитических реакций обычно описывается уравнениями, найденными эмпирически, и формальный порядок таких каталитических реакций будет выражаться как в виде целого, так и дробного числа. В гомогенно-каталитических реакциях скорость процесса зависит от концентрации не только реагирующих веществ, но и катализатора. Основным недостатком гомогенного катализа является трудность выделения катализатора из конечной продукционной смеси, в результате чего часть катализатора теряется, а целевой продукт загрязняется. Однако в последнее время ведутся обширные исследования в области высокоактивных катализаторов гомогенного катализа, которые, присутствуя в малых дозах, вызывают цепные реакции. Поскольку количество вводимого катализатора невелико, после реакции он не извлекается из реакционной смеси, а остается в целевом продукте, не снижая качества получаемого целевого продукта.
Большой интерес к гомогенному катализу объясняется главным образом тем, что при подборе соответствующих катализаторов интенсивность гомогенных процессов очень высока. Это объясняется тем, что гомогенные реакции протекают на микроуровне (на уровне отдельных молекул), когда вероятность столкновения молекул реагирующих веществ с молекулами катализатора весьма значительная.
Дата публикования: 2015-10-09; Прочитано: 2470 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
