 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Работа №2. Дегидратация этилового спирта
|
|
Цель работы: ознакомление с особенностями проведения и расчётом сложного обратимого гетеро-каталитического процесса.
2.1. Теоретические сведения
Этанол широко применяется в химической промышленности, в частности, он используется для получения бутадиена-1,3, который является мономером в производстве синтетического каучука. Суммарное уравнение предложенного С.В.Лебедевым синтеза на бифункциональном дегидрирующе-дегидратирующем катализаторе (например, (Al2O3+ZnO)), может быть представлено следующим образом:
 |
2С2Н5ОН СН2=СН-СН=СН2 + 2Н2О + Н2 - Q (2.1)
Направление протекания реакции определяется используемым катализатором и температурой проведения процесса. В присутствии дегидратирующего катализатора (a- Al2O3) при температурах 420-450оС происходит образование этилена [1]:
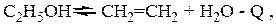 (2.2)
(2.2)
При этом могут протекать побочные реакции образования ацетальдегида и диэтилового эфира:
C2H5OH ® CH3COH + H2, (2.3)
2C2H5OH ® C2H5OC2H5 + H2O. (2.4)
Константа равновесия целевой реакции (2.1) описывается уравнением
KP = Pэт× Pв/Pсп, (2.5)
где Pэт, Pв и Pсп - равновесные парциальные давления этилена, водяных паров и спирта соответственно.
Величину Кр можно рассчитать по уравнению
lg KP = -DGT/(2,303× R× T), (2.6)
где DGT - изменение энергии Гиббса для реакции (2.2) при данной температуре, Дж/моль; R - газовая постоянная (8,314 Дж/моль×К); T - температура, К.
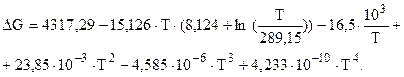 Изменение энергии Гиббса определяется по уравнению
Изменение энергии Гиббса определяется по уравнению
(2.7)
В таблице 2.1 приведены значения констант равновесия реакции (2.2).
Таблица 2.1. Зависимость константы равновесия реакции дегидратации этилового спирта от температуры
| Температура, °С | |||||
| Константа равновесия | 36,32 | 275,09 | 1127,65 | 3165,29 | 6920,37 |
В связи с тем, что реакция дегидратации этанола сопровождается эндотермическим эффектом и увеличением объёма, для повышения равновесной степени превращения необходимо поднять температуру процесса и снизить парциальное давление паров этилового спирта, проводя процесс при пониженном давлении.
Несмотря на то, что повышение температуры благоприятно влияет на кинетику и состояние равновесия реакции (2.1), увеличение её ограничивается возможностью протекания побочных процессов и полимеризацией этилена на поверхности катализатора с последующим закоксовыванием его поверхности. Оптимальной температурой считается интервал от 400 до 450оС, который характеризуется достаточно высокими значениями константы равновесия (табл. 2.1).
Для снижения парциальных давлений проводят быструю конденсацию паров воды и непрореагировавшего спирта на выходе из слоя катализатора.
2.2. Описание установки и методика проведения работы
Схема установки для проведения каталитической дегидратации этилового спирта представлена на рисунке. Для проведения реакции (2.2) этиловый спирт с помощью дозирующего устройства подают в нагретую до заданной температуры (измеряется термопарой) реакционную трубку из кварцевого стекла, заполненную катализатором. Реакционная трубка находится в электрической печи. Регулирование нагрева осуществляется терморегулятором.
В реакционной трубке спирт испаряется на кварцевой насадке и в виде паров поступает в слой катализатора, где осуществляется процесс дегидратации.
 |
Схема установки для дегидратации этилового спирта:
1-дозирующее устройство; 2-терморегулятор; 3-термопара; 4- электрическая печь; 5-реакционная стеклянная трубка; 6-кварцевая испарительная насадка; 7-слой катализатора; 8-приёмная колба; 9-водяной холодильник; 10-склянка Тищенко; 11, 12, 13, 14-краны; 15-газометр
Продукты реакции и непрореагировавший спирт поступают в приёмную колбу и частично конденсируются в холодильнике. Газообразные продукты из холодильника поступают в склянку Тищенко, заполненную концентрированным раствором едкого натра, где очищаются от ацетальдегида и диэтилового эфира, после чего поступают в газометр. Для облегчения отвода продуктов реакции и для предотвращения поступления газов в атмосферу в процессе работы целесообразно поддерживать в системе напряжение, что достигается с помощью вытекания жидкостей из газометра через кран 14.
2.3. Методика проведения эксперимента
Перед проведением дегидратации этилового спирта проверяют правильность сборки установки согласно рисунку. Заполняют дозирующее устройство этиловым спиртом и, отсоединив газометр, нагревают печь до заданной температуры проведения процесса. Присоединяют газометр и проверяют герметичность установки, открывая краны 12 и 14 для создания в системе разрежения. При полной герметичности установки (краны 11 и 13 закрыты) пузырьки газа быстро перестают проходить через склянку Тищенко, а из крана 14 не поступает вода. В случае негерметичности устраняют неисправность (неплотные соединения, отсутствие смазки в кранах и др.). При полной герметичности установки (краны 12, 14 открыты) приступают к подаче спирта в реакционное пространство с помощью дозирующего устройства с заданной скоростью и фиксируют время начала подачи этилового спирта. После окончания подачи спирта фиксируют время, а установку оставляют на 2-3 минуты в рабочем состоянии для конденсации остатков исходных продуктов и отвода остатка газа в газометр. Записывают время, в течение которого производилась подача спирта в реакционное пространство. По окончании процесса газометр отсоединяют от установки, выключают обогрев печи, сливают образовавшийся конденсат из приёмной колбы в предварительно взвешенную колбу на 25 мл.
Количество собранного газа измеряют по градуировке газометра. Одновременно фиксируют комнатную температуру и атмосферное давление.
Собранный газ анализируют на приборе Орса IX-1 путём поглощения образовавшегося этилена бромной водой:
CH2=CH2 (газ) + Br2 (ж) ® CH2Br–CH2Br (ж). (2.8)
Полученные результаты заносят в таблицы 2.2 и 2.3
Таблица 2.2. Параметры проведения дегидратации этилового спирта
| Объём спирта, Vсп, мл | Концентрация спирта (С), % об. | Условия опыта | Параметры окружающей среды | ||||
| Температура в реакторе, °С | Время опыта (t), мин | Объём | |||||
| катализатора, (Vк) см3 | образовав-шегося газа, (Vг), л | Температура (t), °С | Давление (P), мм.рт.ст | ||||
| … |
Таблица 2.3. Результаты анализа газа
| Показатели | Условные значения |
| Начальный отсчёт, мл | |
| Промежуточные отсчёты, мл | |
| Конечный отсчёт, мл | |
| Количество поглощённого газа, мл | |
| Содержание этилена в газе, % (Сэт) |
2.4. Обработка экспериментальных результатов
Дата публикования: 2015-10-09; Прочитано: 3430 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
