 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Метод електронного балансу
|
|
Стехіометричні коефіцієнти у рівняннях окисно-відновних реакцій зручно визначати, користуючись методом електронного балансу. Цей метод ґрунтується на порівнянні ступенів окиснення атомів у початкових і кінцевих умовах. Для встановлення коефіцієнтів виходять з того положення, що число електронів, відданих відновником, повинно дорівнювати числу електронів, приєднаних окисником. Існує певний алгоритм складання рівнянь окисно-відновних реакцій.
1. Записати схему рівняння.

2. Визначити, які атоми змінюють ступінь окиснення.
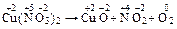
Отже, відновником є 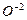 , окисником -
, окисником - 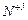 .
.
3. Скласти електронні рівняння процесів окиснення та відновлення. Підібрати коефіцієнти в цих схемах так, щоб загальне число електронів, які віддає відновник, дорівнювало загальному числу електронів, що приєднує окисник.
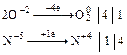
4. Розставити знайдені коефіцієнти у молекулярному рівнянні.
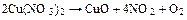
5. Підібрати інші коефіцієнт таким чином, щоб загальне число атомів кожного елемента було однаковим у лівій та правій частинах рівняння.
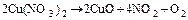
3.2 Завдання для самостійного розв’язання
3.2.1 Відповісти на запитання та виконати завдання
1. Які реакції називають окисно-відновними? Що таке окисники, відновники, процеси окиснення, відновлення?
2. Які із сполук 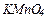 ,
, 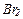 ,
, 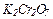 ,
, 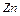 ,
,  ,
,  ,
, 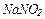 ,
,  ,
, 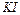 ,
, 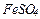 здатні бути тільки окисниками, які тільки відновниками, які здатні виявляти і окисні і відновні властивості в залежності від умов реакцій?
здатні бути тільки окисниками, які тільки відновниками, які здатні виявляти і окисні і відновні властивості в залежності від умов реакцій?
3. Користуючись методом електронного балансу розставити коефіцієнти в рівняннях окисно-відновних реакцій. Вказати окисник та відновник, процеси окиснення та відновлення. Визначити Мекв окисників і відновників.
а) 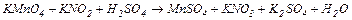
б) 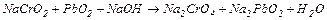
в) 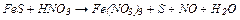
г) 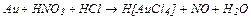
д) 
4. Закінчити рівняння реакцій, за допомогою електронного балансу розставити коефіцієнти, вказати окислювач і відновник.
а) 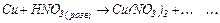
б) 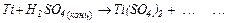
в) 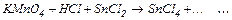
г) 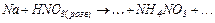
д) 
5. Розставити коефіцієнти за допомогою методу електронного балансу в рівняннях окисно-відновних реакцій. Вказати окисники та відновники.
Дата публикования: 2015-09-17; Прочитано: 1048 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
