 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Робота № 2. Виділення запасних білків та вивчення їх властивостей
|
|
Основні відомості. Для виявлення білків найчастіше користуються трьома якісними реакціями на білки: біуретовою і ксантопротеїновою. Білки поділяють на розчинні і нерозчинні у воді.
Мета роботи. Виявити білки, користуючись трьома якісними реакціями на білок.
Матеріали, реактиви, обладнання. Фільтрувальний папір, пробірки, горілки, мірні циліндри, розчин горохового борошна, (NH4)2SO4, NaOH, HNO3, CuSO4, оцтовокислий свинець 5%.
Хід роботи. 3-5 г горохового борошна залити в колбі 20-30 мл 10%-ного розчину (NH4)2SO4 (сірчанокислий амоній).
Колбу закрити пробкою і добре збовтувати протягом 3 хв, а потім залишити на 30 хв, після чого профільтрувати крізь складчастий, змочений тим же розчином солі, фільтр.
У фільтрат перейдуть нерозчинні у воді білки – глобуліни. З ними можна провести такі реакції:
Осадження білку:
1. В пробірку налити 1 мл одержаного фільтрату і долити води. У розчині виникає муть, бо глобулін випадає в осад. Додати розчин сірчанокислого амонію (NH4)2SO4 – білок знову розчиняється.
2. У пробірку налити 2-3 мл розчину білка, і нагрівати поступово, довести до кипіння. Чи розчиняється осад після охолодження?
3. У пробірку набрати першого фільтрату і до нього додати суху поварену сіль до появи помутніння, потім додати води. Чи переходить осад в розчин?
4. У пробірку налити 2-3 мл розчину білка і додавати по краплі концентровану HNO3 (до появи осаду). Чи розчиняється осад після додавання HNO3.
Кольорові реакції на білок:
1. Ксантопротеїнова реакція: Ця реакція показує на присутність в молекулах білка фенілаланіну або тирозину, або триптофану. До розчину білка додається конц. HNO3, відбувається коагуляція, розчин підігрівають (визначити колір білка). При охолодженні додаємо по краплині аміак (визначаємо колір).
2. Біуретова реакція: Цю реакцію дають сполуки, що мають групу СОNH і складаються з кількох амінокислот. До розчину білка додати 10% розчин NaOH. Потім по краплях додавати слабкий розчин CuSO4, визначаємо колір розчину.
3. Реакція на сірку амінокислот цистеїна та цистина. До розчину білка додати вдвічі більший об’єм 10% розчину NaOH, обережно кип’ятити 2-3хв. Додати кілька крапель оцтовокислого свинцю (5%).
Робота № 3. Визначення дубильних речовин та алкалоїдів у рослинах.
Основні відомості. В зеленій рослині вуглеводи та білки є первинним матеріалом, який утворюється безпосередньо із неорганічних сполук у процесі фотосинтезу. А вже з них внаслідок різних хімічних перетворень у живій клітині виникають усі інші органічні сполуки, які є речовинами вторинного походження. Це: органічні кислоти, дубильні речовини, алкалоїди, антибіотики та фітонциди.
Дубильні речовини є в багатьох рослинах. Вони є похідними галлової та протокатехової кислот. За своєю хімічною природою близькі до антоціанів і похідних флавону та флавонолу. Вони утворюють з білками нерозчинні сполуки.
Алкалоїди – органічні азотовмісні речовини рослинного походження, що мають основний характер і здебільшого гетероциклічну будову. За хімічною будовою їх поділяють на похідні хіноліну, ізохіноліну, індолу, піридину, піперидину, пурину тощо. Алкалоїди містяться в рослинах найчастіше у вигляді солей яблучної, лимонної, винної та інших кислот, розчинних у воді. Алкалоїди – надзвичайно фізіологічно активні речовини і впливають на тваринний організм, багато з них є отрутами.
Мета роботи. Ознайомитися з методикою визначення вторинних речовин рослини – алкалоїдів і дубильних речовин. Порівняти їх кількісний вміст у різних рослинних об’єктах.
Матеріали, реактиви, обладнання. Спиртівки, штативи з пробірками, предметні скельця, пробіркотримачі, фарфорові тарілки, скляні палички, розчин йоду в йодистому калії, хлорне залізо, кора дуба, листя чаю, тютюну, насіння люпину алкалоїдного та ін.
Хід роботи. Характерною реакцією на дубильні речовини являється почорніння їх при обробці слабким розчином якої-небудь солі заліза, наприклад хлорного заліза (утворення чорнил).
1. Сухий рослинний матеріал розміром з горошину кип’ятять у пробірці з 5-6 мл води, додавши 1-2 краплини хлорного заліза.
2. Віджати краплину соку з рослинного матеріалу на тарілку, до неї додати краплину хлорного заліза.
3. Нанести краплину хлорного заліза на щойно виготовлений зріз досліджуваного рослинного матеріалу.
Результати дослідів записують до таблиці:
| Ступінь почорніння | ||||
 Назва рослини Назва рослини
| Частина рослини | Слабе | Середнє | Сильне |
Характерною реакцією наалкалоїди є утворення червонувато-бурого осаду при їх обробці розчином йоду в йодистому калії. Старанно розтерти рослинний матеріал (шматочки коріння, листка, плоду) скляною паличкою на тарілці до утворення каші і додати декілька краплин розчину йоду в йодистому калії. Червонувато-бурий колір говорить про наявність алкалоїдів.
Результати дослідів записують до таблиці:
| Назва рослини | Частина рослини | Кількість осаду | ||
| Багато | Середньо | Мало | ||
Контрольні питання.
1. Що таке речовини вторинного походження?
2. Що таке алкалоїди?
3. Що таке дубильні речовини?
Робота № 4. Виготовлення «штучної» клітини Траубе.
Основні відомості. Рослинна клітина нагадує цитоплазматичний мішечок, в середині якого розташована центральна вакуоль, оточена тонопластом. Вакуоля – своєрідний резервуар, виповнений клітинним соком. Водорозчинні сполуки, які зумовлюють осмотичний потенціал клітинного соку, вибіркова напівпроникність поверхневих мембран цитоплазми, еластичність клітинної оболонки дають змогу розглядати клітину як своєрідний природний осмометр. Вивчення осмотичних явищ в клітині найчастіше починають з таких простих моделей, як виготовлення «штучної» клітини Траубе.
Мета роботи. Навчитися виготовляти «штучну» клітину Траубе, вивчити на ній напівпроникність поверхневих мембран цитоплазми та осмотичні явища в клітинній оболонці.
Матеріали, реактиви, обладнання. Мікроскопи, предметні скельця, пробірки, піпетки, 0,5 н.розчин CuSO4, 1 н.розчин K4[Fe(CN)6], 0,5 н. розчин K4[Fe(CN)6], 0,25 н. розчин K4[Fe(CN)6].
Хід роботи.
1. У пробірку наливають 3/4 об’єму 0,5 н. розчину CuSO4 і піпеткою обережно по стінкам пробірки спускають 1-2 краплі 1 н. розчину K4[Fe(CN)6]. На поверхні краплі розчину жовтої кров’яної солі, при попаданні її в розчин мідного купоросу утворюється напівпроникна плівка гексаціаноферату міді. Реакція відбувається за такими рівнянням:
2CuSO4 + K4[Fe(CN)6] ® Cu2[Fe(CN)6]+2KSO4 .
При цьому утворюється замкнений міхурець, який дістав назву «штучної» клітини. Плівка міхурця проникна для води і непроникна для солей. Оскільки концентрація розчину K4[Fe(CN)6] у цій клітині більша, ніж концентрація розчину CuSO4, що оточує її, то вода з розчину надходитиме в середину «штучної» клітини. При цьому клітина збільшуватиметься в об’ємі доти, поки концентрація всередині міхурця і біля нього не зрівняються. Під час збільшення об’єму «штучної» клітини плівка часто не витримує тиску і розривається. На місці розриву міхурця при стиканні з розчином CuSO4 знову утворюється перегородка і вода надходитиме в міхурець до нового розриву.
Якщо розглядати «штучну» клітину на світлі, то можна помітити, що під час її збільшення струминки розчину CuSO4 опускаються на дно пробірки. Це відбувається тому, що під час збільшення об’єму міхурця в результаті надходження води концентрація навколишнього розчину збільшується і важчі його шари опускатимуться донизу. Якщо розчин K4[Fe(CN)6] взяти меншої концентрації, ніж розчин CuSO4, то міхурець навпаки, буде зменшуватися і струминки підніматимуться вгору, оскільки тут відбуватиметься протилежний процес.
«Штучну» клітину ще краще виготовляти під мікроскопом. Для цього на предметне скло кладуть маленький кристалик жовтої кров’яної солі і наносять на нього краплину розчину мідного купоросу. Препарат швидко розглядають під мікроскопом при малому збільшенні. В полі зору добре видно, як навколо кристалика K4[Fe(CN)6] утворюється міхурець рожевого кольору, який весь час збільшується в об’ємі. Ця «штучна» клітина збільшується нерівномірно доти, поки не розчиниться кристалик і не вирівняється концентрація.
Описати і замалювати результати дослідів.
Контрольні питання.
1. Як виготовити «штучну» клітину Траубе?
2.Які властивості характерні для перегородки з гексаціаноферрату міді?
3.Яку властивість живої цитоплазми можна вивчити на штучній моделі клітини Траубе?
Робота № 5. Явища плазмолізу і деплазмолізу. Форми плазмолізу.
Основні відомості. Наочним проявом осмотичних і життєздатних властивостей рослинних клітин є явище плазмолізу та деплазмолізу. Плазмоліз – це явище відокремлення протопласта від клітинної стінки внаслідок втрати ним води шляхом осмосу. Плазмоліз можна спричинити, помістивши клітини в гіпертонічний розчин, тобто розчин, концентрація якого більша, ніж вакуольного соку. Внаслідок цього більш концентрований зовнішній розчин відбирає воду від вакуолі, об’єм якої зменшується, і шар цитоплазми, що був притиснутий вакуолею до оболонки, відстає від неї. Якщо цю саму клітину перенести в гіпотонічний розчин або звичайну воду, то спостерігатиметься зворотна картина – протоплазма, насичуючись водою, займе попереднє положення, настає деплазмоліз.
Плазмоліз найкраще спостерігати у рослин із забарвленим клітинним соком, оскільки сама цитоплазма безбарвна. Тому для роботи краще використовувати епідерму синьозабарвлених лусок цибулі, червоної капусти, традесканції.
За певних умов освітлення та стану цитоплазми на початковій стадії плазмолізу можна спостерігати її тоненькі тяжі, що тягнуться від поверхні протопласта до пор в оболонці. Це плазмодесмові нитки (нитки Хехта), які свідчать про в’язкість та еластичність протоплазми. Залежно від цього виникають різні форми плазмолізу: угнутий, кутовий, опуклий, спазматичний, ковпачковий (рис.).
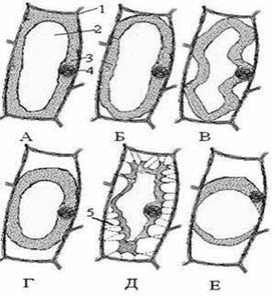
Рис. 1.1. Різні форми плазмолізу в клітинах епідерми цибулі:
А – плазмоліз відсутній; Б – кутовий; В – увігнутий; Г – опуклий; Д – судомний; Е – ковпачковий;
1 – клітинна стінка; 2 – вакуоля; 3 – цитоплазма; 4 – ядро.
На форму плазмолізу впливають іони плазмолітика. Іони калію зменшують, а іони кальцію підвищують в’язкість цитоплазми. Інколи у суміжних клітинах спостерігаються різні форми плазмолізу, що свідчить про їх неоднорідність.
Здатність клітини до плазмолізу є достовірним показником її життєздатності та структурно-функціональної цілісності. За повільного плазмолізу клітина залишається живою. За наявності доступної для клітини води вони легко відновлюють стан тургору. Тривалий плазмоліз зумовлює
загибель клітин. Явище плазмолізу використовують для визначення осмотичного потенціалу, в’язкості цитоплазми, проникності клітинних мембран тощо.
Мета роботи. Ознайомитися з явищами плазмолізу й деплазмолізу, визначити потрібні для цього умови і значення цих явищ у процесах життєдіяльності рослинних клітин.
Матеріали, реактиви, обладнання. Цибуля ріпчаста синя або листки інших об’єктівіз забарвленим клітинним соком, скальпелі, препарувальні голки, предметні скельця, мікроскопи; 1 М розчини плазмолітиків (NaCl або сахароза), скляні палички, фільтрувальний папір, пінцети.
Хід роботи.
З луски цибулі знімають пінцетом шматочки забарвленої епідерми і швидко кладуть у краплину води на предметне скло і накривають покривним скельцем.
2. Виготовлений препарат спочатку розглядають при малому збільшенні, під час якого вибирають місце з добре забарвленими клітинами.
3. Зарисувати клітини епідерми цибулі.
4. Беруть смужку фільтрувального паперу і прикладають її до краю накривного скельця, а з протилежного боку піпеткою опускають кілька крапель 1 М розчину сахарози або хлориду натрію. Розглядають препарат під мікроскопом. В результаті адсорбції води папером під накривне скельце надходить розчин плазмолітика. Через 1-3 хв. протоплазма починає відставати від оболонки: спочатку по кутах клітини, спостерігається так званий кутовий плазмоліз. З часом відставання цитоплазми збільшується і спостерігається угнутий плазмоліз, а весь протопласт відстане від оболонки і округлиться наступає опукла форма плазмолізу.
Зарисувати клітини в стані плазмолізу.
5. Щоб виявити явище деплазмолізу, беруть препарат з плазмолізованими клітинами, прикладають до накривного скельця смужку паперу, а з другого боку скельця піпеткою опускають кілька крапель води. Концентрація в клітинах вища, ніж зовні, а тому рідина рухається в напрямку до більшої концентрації. При цьому цитоплазма насичуватиметься водою і займе попереднє положення – настає деплазмоліз.
Щоб виявити нездатність мертвих клітин плазмолізуватися, виготовляють мікропрепарат і нагрівають його на полум’ї спиртівки, щоб вбити живі клітини. Готовий препарат розглядають під мікроскопом. Плазмоліз не виявляється.
Контрольні питання.
1. Що міститься між оболонкою клітини і плазмолізованим протопластом?
2. Що таке нитки Хехта, коли вони виникають?
3. Що таке плазмоліз і які його причини?
4. Як відбувається деплазмоліз?
5. Чому плазмоліз спостерігається тільки в живих клітинах?
6. Які осмотично активні речовини містить вакуолярний сік?
7. Які форми плазмолізу вам відомі?
8. Які розчини використовують для спостереження явищ плазмолізу та деплазмолізу?
9. Яку роль в рослинних клітинах відіграють цитоплазматичні мембрани?
10. Чим плазмоліз відрізняється від циторізу?
Робота № 6. Визначення осмотичного тиску клітинного соку плазмолітичним методом (за де-Фрізом).
Основні відомості. Концентрацію клітинного соку, який являє собою розчин великої кількості різноманітних органічних і неорганічних сполук, можна визначити за його осмотичним потенціалом. Плазмолітичний метод визначення цього показника полягає в тому, що зрізи досліджуваної тканини занурюють в розчини різних концентрацій і проводять дослідження їх під мікроскопом для виявлення ізотонічного розчину. Виходячи з того, що плазмоліз відбувається лише в гіпертонічних розчинах, знаходять таку концентрацію, при якій спостерігається початкова стадія плазмолізу не менше ніж у 50% клітин досліджуваної тканини. Ізотонічний розчин матиме середнє значення між цим розчином і наступним, в якому плазмоліз ще не відбувався.
Мета роботи. Визначення величини осмотичного тиску у рослин різних екологічних груп.
Матеріали, реактиви, обладнання. Мікроскопи, предметні і накривні скельця, леза, бюкси, пінцети, препарувальні голки, піпетки, склограф, фільтрувальний папір, синя цибуля, червоноголова капуста, листки традесканції; 1 М розчин сахарози або 1 М розчин NaCl, дистильована вода.
Хід роботи.
1. Приготувати 7 розчинів NaCl або сахарози різної концентрації (від 0,1 до 0,7 мольл) з вихідного 1 М розчину, по 5 мл, згідно з таблицею:
| Концентрація плазмолітика, моль/л | Ступінь плазмолізу | Для приготування 5 мл розчину | |
| 1 М сахароза, мл | вода, мл | ||
| 0,1 | 0,5 | 4,5 | |
| 0,2 | 1,0 | 4,0 | |
| 0,3 | 1,5 | 3,5 | |
| 0,4 | 2,0 | 3,0 | |
| 0,5 | 2,5 | 2,5 | |
| 0,6 | 3,0 | 2,0 | |
| 0,7 | 3,5 | 1,5 |
1. Розчини наливають у пробірки з відповідними позначками і добре перемішують; закривають кришками, щоб не було випаровування. За допомогою леза готують 14 зрізів з опуклої сторони лусок синьої цибулі або інших об’єктів. Зрізи покласти у холодну кип’ячену воду для видалення бульбашок повітря, слідкуючи, щоб зрізи повністю були занурені у воду.
2. Фіксуючи в таблиці час з інтервалом у 5 хвилин, за допомогою препарувальної голки обсушити на фільтрувальному папері по 2 зрізи (для кожної пробірки) і на 20 хвилин занурити їх у розчини від найвищої концентрації до нижчої. Зрізи повинні бути повністю занурені в розчин.
3. Через 20 – 30 хвилин зрізи витягують з розчинів і розглядають під мікроскопом в порядку занурення.
4. Необхідно встановити, при якій концентрації плазмолітика починається плазмолізх, а при якій ні. Результати спостережень записати у таблицю (у графі ступінь плазмолізу – «+» або «-»).
5. При спостереженні плазмолізу встановлено, що зовнішній розчин гіпертонічний, тобто має вищу концентрацію, ніж клітинний сік. Концентрація ізотонічного розчину рівна концентрації клітинного соку, гіпотонічного – нижча.
6. Знайти ізотонічну концентрацію, вирахувати величину осмотичного тиску клітинного соку за рівнянням Вант-Гоффа:
P=RTCi.
де P – осмотичний тиск в мегапаскалях, Мпа; R – універсальна газова стала, 0,0083кДж/(град×моль); T – абсолютна температура, 273°+°C; C – концентрація, моль/л; значення С беруть середнє від: де плазмоліз спостерігається та де він відсутній. Наприклад, при двох значеннях 0,5 та 0,4, тоді С= 0,45 м/л.; i – ізотонічний коефіцієнт (для NaCl значення наведені в таблиці, для розчинів неелектролітів і=1).
| Концентрація плазмолітика, моль/л | 1,0 | 0,8 | 0,7 | 0,6 | 0,5 | 0,4 | 0,3 | 0,2 |
| Ізотонічний коефіцієнт | 1,62 | 1,64 | 1,66 | 1,68 | 1,70 | 1,75 | 1,78 | 1,83 |
7. Результати записати у вигляді таблиці:
| Концентрація розчину, моль/л | 0,7 | 0,6 | 0,5 | 0,4 | 0,3 | 0,2 | 0,1 |
| Ступінь плазмолізу | |||||||
| Рисунок клітин |
Зробити висновок про залежність ступеню плазмолізу від концентрації розчину.
Контрольні питання.
1. При якій концентрації плазмолітика помітно початкову стадію плазмолізу?
2. Який склад клітинного соку клітини?
3. Чому розчини електролітів мають більший, порівняно з неелектролітами, осмотичний тиск?
4. Які фактори можуть впливати на проникність мембран?
5. Чи можна визначити концентрацію клітинного соку плазмолітичним методом?
6. Чи можна відібрати воду від плазмолізованої клітини?
7. Чому під час тривалих дощів плоди абрикосу, сливи, вишні розтріскуються?
Робота № 7. Визначення сисної сили тканин методом вимірювання відрізків (за М.Ф. Лілієнштерн).
Основні відомості. Якщо рослинну тканину занурити в розчин, осмотичний тиск якого менше сисної сили тканини, то її клітини будуть поглинати воду з розчину. В результаті чого розчин стає концентрованішим, ніж до занурення в нього об’єкта. Навпаки, коли тканину помістити в гіпертонічний розчин, то він відбиратиме воду з клітин і ставатиме менш концентрованим.
Величина сили тиску, з яким вода осмотичним шляхом надходить до вакуолі, дорівнює різниці між осмотичним тиском (P) і тургорним тиском (T). Цю величину називають сисною силою (S):
S = P – T,
яка залежить від ступеню насиченості клітини водою. В стані повного в’янення (або початкового плазмолізу) тургорний тиск відсутній і сисна сила дорівнює осмотичному тиску T = 0, S = P.
Мета роботи. Визначити величину сисної сили досліджуваних тканин методом вимірювання відрізків.
Матеріали, реактиви, обладнання. 1 Н розчин NaCl або сахарози, дистильована вода, піпетки, склографи, леза, бюкси; коренеплоди моркви або бульби картоплі, міліметровий папір, препарувальні голки, скляні палички.
Хід роботи.
1. Вихідний розчин 1 Н сахарози (342 г на 1 л води). Приготувати розчини сахарози або NaCl, які зменшуються на 0,1 Н, відповідно до таблиці:
| Концентрація дослідного розчину, моль/л | на 10 мл розчину | |
| 1 н. розчин сахарози, мл | води, мл | |
| 1,0 | 10,00 | 0,00 |
| 0,9 | 9,00 | 1,00 |
| 0,8 | 8,00 | 2,00 |
| 0,7 | 7,00 | 3,00 |
| 0,6 | 6,00 | 4,00 |
2. Налити приготовлені розчини в пробірки по 10 мл кожного і розмістити в штативі за зростанням їх концентрацій.
3. З паренхіми коренеплоду моркви або бульби картоплі вирізають смужки довжиною 30 мм (вимірюючи міліметровою лінійкою), шириною і товщиною 2-3 мм. Точність вимірювання ±0,5 мм.
4. Потім брусочки занурюють в розчини різної концентрації. Через 20 -30 хв. після занурення зрізів в розчини вимірювання повторюють.
Розчин, в якому довжина зрізів залишилась без змін, за своїм осмотичним тиском буде дорівнювати сисній силі тканин.
5. Розрахувати осмотичний тиск за рівнянням Вант-Гоффа
P=R∙T∙Ci, де
R – універсальна газова постійна (0,00831 кДж/град.моль);
T – абсолютна температура (273+1°С);
C – концентрація розчину, моль/л;
I – ізотонічний коефіцієнт.
Всисна сила розчину дорівнює осмотичному тиску, через відсутність тургорного тиску:
S розчину =P розчину =S тканини, тобто P розчину = S тканини
Результати записати у вигляді таблиці:
| Концентрація розчину, моль/л | 1,0 Н | 0,9 Н | 0,8 Н | 0,7 Н | 0,6 Н |
| Довжина смужки до занурення в розчин, мм | |||||
| Довжина смужки після занурення в розчин, мм |
Розрахунки такі ж, як і при визначенні осмотичного тиску. Приклад розрахунку:
1 моль/л - 22,4 атм
0,25 моль/л - x,
тоді
X = 22,4 · 0,25 = 5,6 атм
Контрольні питання.
1. Що розуміють під сисною силою клітин? Від яких факторів залежить всисна сила тканин?
2. Як визначити величину сисної сили? Якими методами?
3. Пояснити причини зміни розмірів брусочків в розчинах різної концентрації.
4. Які розчини називають гіпотонічними, гіпертонічними, ізотонічними?
5. Намалювати залежність між P, S і π* (для ідеальної клітини). Пояснити.
6. Чому дорівнює тургор ний тиск і всисна сила клітини при повному насиченні її водою.
Робота № 8. Визначення сисної сили клітини спрощеним методом по Уршпрунгу
Мета: Ознайомитися зі станом клітин у гіпо- та гіпертонічному розчинах і визначити величину сисної сили досліджуваних рослинних тканин.
Матеріали та обладнання: коренеплід столового буряку або картоплі, бюретки, лійка, скальпель, пінцет, фарфорові чашки, картонні кришки, міліметровий папір, і М р-н сахарози, рефрактометр, штатив з великими та маленькими пробірками, піпетки.
Основні поняття: сисна сила, тургор, тургорний тиск,
Хід роботи:
Сисна сила відображує здатність рослинної клітини поглинати воду в кожний конкретний момент. Величина її змінюється в залежності від осмотичного і тургорного тиску клітинного соку. Залежно від осмотичного тиску і наявності води змінюється і довжина рослинної смужки.
Розчини з великих пробірок (9 мл) переливають у фарфорові чашки і прикривають їх картонними кришками вказаної концентрації.
На препарувальному склі роблять смужки з бульби картоплі довжиною. 20 мм та шириною 5 мм, товщиною 2-3 мм. В кожну чашку занурюють по 2 смужки картоплі і залишають на 20-30 хв. Після досліду за допомогою міліметрового паперу заміряють довжину смужки. Результати записують у таблицю.
Сама коротка смужка має Т1 = 0, тоді Р1 = S1. Для кожної концентрації визначають по формулі S = RТСі.
Між осмотичним тиском і довжиною смужки існує протилежна
залежність.
Р1 = l2; звідси P2 = Р1* l1; P3 = Р1* l1 і т.д.
P2 l1 l2 l3
Тургор дорівнює Р - S, тобто Т2 = Р2 – S2 і т.д. На основі одержаних даних будуємо графік залежності між величинами Р, S та Т.
| С (С12Н22О11), М | 0,9 | 0,8 | 0,7 | 0,6 | 0,5 | 0,4 | 0,3 | 0,2 | 0,1 |
| S | |||||||||
| Р | |||||||||
| Т | |||||||||
| Довжина смужки до досліду, мм | |||||||||
| після досліду, мм |
По закінченню роботи заповнити таблицю і записати висновок.
Контрольні питання:
1. Що таке сисна сила клітин? Від яких факторів залежить її величина?
2. За якою формулою і в яких одиницях визначають сисну силу клітин?
3. Суть методу визначення сисної сили рослинної клітини по Уршпрунгу?
3. Чому під час використання розчинів сахарози різної концентрації змінюється довжина смужки?
4. Поясніть зміну довжини смужки під час занурення її в гупер- та гіпотонічний розчини?
6. Які фактори впливають на точність досліду?
Дата публикования: 2015-09-18; Прочитано: 4061 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
