 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Добування та застосування
|
|
Оксикислотами називаються похідні вуглеводнів, маючі у молекулі два види
О
½½
функціональних груп: гідроксильні ОН та карбоксильні - С - ОН -. У залежності від кількості карбоксильних груп відрізняють одно-, двух- та багатоосновні оксикислоти, а від числа гідроксильних груп - двух-, трьох- та багатоатомні оксикислоти.
По будові вуглецевого радикалу, з яким пов'язані оксі- та карбрксильні групи, оксикислоти діляться на аліфатичні (насичені та ненасичені), ароматичні, гетероцекличні та інші:
НО-СН2-СООН гліколева, оксіоцтова (одноосновна, двуатомна оксикислота)
ОН
½
СН3-СН-СООН молочна (одноосновна, двуатомна оксикислота)
НООС-СН-СН2-СООН яблучна (двухосновна, трьохатомна оксикислота)
½
ОН
НООС-СНОН-СНОН-СООН винна (двухосновна, чотирьохатомна оксикислота)
СООН галлова (одноосновна, чотирьохатомна ароматична оксикислота)
 ½
½
 |  |  |
 НО ОН
НО ОН
ОН
ОН
½
НООС-СН2-С-СН2-СООН лимонна (трьохосновна, чотирьохатомна оксикислота)
½
СООН
Фізичні властивості. Оксикислоти - безбарвні тягучі рідини чи кристалічні речовини. Нижчі добре розчинні у воді, зі збільшенням молекулярної маси розчинність зменшується.
Хімічні властивості. Оксикислоти взаємодіють з багатьма хімічними реакціями, характерних для кислот (присутність групи СООН) та спиртів (присутність групи ОН). Будова вуглецевого радикалу теж оказується на їх хімічній поведінці - ароматичні оксикислоти вступають у перетворення, характерні для відповідних похідних бензолу. У одних хімічних реакціях кожна з функціональних груп може приймати участь незалежно друг від друга. а в інших хід реакції та характер продуктів, які утворилися, залежить від їх взаємного впливу, у деяких випадках оксі- та карбоксильні групи можуть взаємодіяти між собою.
Кислотні властивості. Введення у молекулу кислоти оксігрупи підвищує силу кислоти: оксикислоти - більш сильні, чим відповідні їм карбонові кислоти.
Вони можуть утворювати солі, складні ефіри, аміди, галогенангідріди. У реакції з РСІ5 може взаємодіяти і спиртова група.
Спиртові властивості. Можливо окиснення вторинної спиртової групи з утворенням кетокислоти (1); заміна спиртової групи на атом галогену (2); утворення простих ефірів (3); складних ефірів (4):
О
½½

 СН3-С-СООН (1)
СН3-С-СООН (1)
 СН3-СН-СООН (2)
СН3-СН-СООН (2)
½
СІ
ОН
½
 СН3-СН-СООН
СН3-СН-СООН  СН3-СН-СООН (3)
СН3-СН-СООН (3)
½
ОСН3
 СН3-СН-СООН (4)
СН3-СН-СООН (4)
½
ОСОС17Н35
Різниця у поведінці a-,b-,g - та d-оксикислот.
а) Дегідратація a- оксикислот. При нагріванні a- оксикислот виділяється вода та утворюється циклічний складний ефір - лактид:
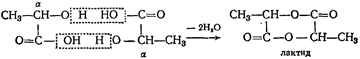
Лактиди - кристалічні речовини, які розлагаються при кип’ятінні у присутності кислот та лугів на вихідних продуктах.
б) b- Оксикислоти при нагріванні втрачають воду з утворенням неприцільних кислот:
b a
СН3-СН-СН2-СООН  СН3-СН=СН-СООН
СН3-СН=СН-СООН
½
ОН
b-оксимасленна кислота кротонова кислота
в) g - та d- Оксикислоти при нагріванні утворюють внутрішні складні ефіри - лактони:
g b a ¤¤ О

 СН3-СН-СН2-СН2-СООН
СН3-СН-СН2-СН2-СООН  СН3-СН-СН2-СН2-С
СН3-СН-СН2-СН2-С
½

 ОН О
ОН О
g-оксивалерьянова кислота лактон g-оксивалерьянової кислоти
Окремі представники. Молочна кислота СН3-СНОН-СООН. Існує у природі у виді двух- оптичних антиподів та рацемат. Гігроскопічна сіропоподібна рідини. Найбільш важливий спосіб добування - молочнокислого бродіння:
С6Н12О ® 2СН3-СНОН-СООН
гексоза молочна кислота
При молочнокислому бродінні сахарів утворюється рацемічна форма молочної кислоти. Молочнокисле бродіння грає велике значення у виробництві молочнокислих продуктів, при виробництві рідких дріжджів для хлібопечення, квашення капусти, огірків.
Молочну кислоту добувають синтетичним шляхом із оцтового альдегіду:
¤¤ О
 СН3-С
СН3-С  СН3-СН-СN
СН3-СН-СN  ® СН3-СН-СООН
® СН3-СН-СООН
Н ½ ½
ОН ОН
оцтовий альдегід молочна кислота
Молочна кислота використовується у шкіряній промисловості при обробці шкіри, текстильній як протрави та в медицині. Велике використання вона знайшла у харчовій промисловості при виробництві цукерок, безалкогольних напоїв.
Яблучна кислота НООС-СН2-СНОН-СООН. Зустрічається у виді двох оптичних антиподів і рацемата. У рослинному мирі широко розміщена ліворухома L-яблучна кислота. Є одною із головних органічних кислот у яблуках, рябині, груші, кізилі. Добувають гідролізом бромянтарної кислоти:
НООС-СН2-СНВr-СООН  ® НООС-СН2СНОН-СООН
® НООС-СН2СНОН-СООН
Використовується у харчовій промисловості в виробництві кондитерських виробів та безалкогольних напоїв.
Винна кислота НООС-СНОН-СНОН-СООН. Зустрічається у виді двох оптичних антиподів, рацемата і мезовиної кислоти.
У природі зустрічається право рухома кислота, має назву виннокам’яна, так як вона була добута із "винного каменя" - залишок, добутого при виробництві та видержці виноградних вин.
Винна кислота у харчовій промисловості використовується при виробництві фруктових вод, хімічних розпушувачів тіста, у аналітичній хімії для визначення іонів калію, у медицині.
СООН
½
Лимона кислота СООН-СН2-С-СН2СООН. Основна органічна кислота плодів
½
НО
цитрусових, у лимонах її міститься біля 9% на суху масу. Кристалічна речовина, добре розчинна у воді. Лимону кислоту добувають із листків махорки, лимонів та біохімічним шляхом за допомогою гриба Aspergillus niger. Використовується у харчовій промисловості при виробництві цукерок, кремів, безалкогольних напоїв, у текстильній промисловості при фарбуванні тканин та медицині.
Лекція № 10
Тема: Поняття про стереоізомерію та оптичну активність органічних сполук.
Мета: Вивчити класифікацію ізомерії. Вміти складати формули ізомерів.
План:
1. Стереохімія вуглецю.
2. Оптична ізомерія.
Стереохімія вуглецю. У органічній хімії відомі два основних види ізомерії - структурна та просторова. До просторової ізомерії відносяться:
1) геометрична (цис- і трас-ізомерія);
2) оптична;
3) поворотна ізомерія.
Розділ органічної хімії, який вивчає просторову будову молекул, його вплав на властивості речовин, на напрямок та швидкість органічних реакцій, називається стереохімією. Перший із перелічених видів просторової ізомерії - геометрична ізомерія - був розглянутий у розділі алкенів, а також карбонових кислот та у інших розділах.
Оптична ізомерія. У 1815р. французький хімік Біо знайшов, що деякі органічні речовини у рідкому та розчиненому стані здібні рухати площину плоскополяризованого світла. Раніше ця особливість була відзначена для кристалів кварцу - при проходженні через них поляризованого струменю відбувається рух площини поляризації, одні кристали рушать її у право, інші - вліво. У 1848р. Л.Пастер знайшов ці здібності у винних кислот. Це явище, назване оптичною активністю, знайшло пояснення у роботах Вант-Гоффа та Ле Беля. Вант-Гофф висказав предположення, що оптична активність органічних сполук пов'язана з присутністю у їх молекулах асиметричного атому вуглецю. Для більшості оптично активних сполук це предположення є вірним.
Присутність асиметричного атому вуглецю у молекулі молочної кислоти приводить до утворення двох просторових ізомерів, які відрізняються друг від друга як несиметричний предмет від свого зображення у дзеркалі. Звідси інша назва оптичної ізомерії - дзеркальна ізомерія. Подібні просторові ізомери називаються дзеркальними ізомерами (енантиометрія) чи оптичними антиподами.
Оптична неактивна модифікація, складена із рівних кількостей двох антиподів, називається рацематом. Рацемати утворюються по ходу хімічної реакції, коли імовірність утворення кожного із оптичних антиподів однакова. Рацемат може уявлювати суміш двох антиподів чи їх молекулярних сполук.
По більшості хімічних та фізичних властивостей оптичні антиподи не відрізняються друг від друга. Різниця лиш у тім, що один із них ліво-, інший праворухомий, та у їх здібності кристальозуватися у енантиоморфні форми.
Рацемическі сполуки відрізняються по своїм фізичним властивостям від енантиомерів.
У останній час молекули органічних сполук, проявляючи оптичну активність та здібних до існування у виді пари енантиомерів, називають хоральними. Хоральні молекули не мають ні центру, ні площини симетрії, но можуть мати ось симетрії. Якщо молекули не мають і осі симетрії, то вони є асиметричними. Асиметричний атом получив назву хорального атому чи хорального центру.
 Лекція № 11
Лекція № 11
Тема: Нітросполуки. Азотовмісні органічні сполуки. Аміни. Амінокислоти.
Мета: Вивчити властивості амінів, їх склад, добування і значення. Розглянути властивості діамінів, амідів кислот.
План:
1. Аміни, їх характеристика.
2. Властивості амінів.
3. Анілін, його характеристика, властивості і значення.
4. Амінокислоти їх характеристика, властивості.
Азотовмісні органічні сполуки.
Органічні сполуки, які містять у молекулі атоми азоту, широко розповсюджені у природі. До них відносяться білкові речовини, багато важливих фізіологічно активних сполук, полімерних матеріалів, фарбники, лікарські препарати.
До групи найбільш простих по будові азоновмісних органічних сполук, у яких атом азоту пов'язаний з атомом вуглецю, можна віднести слідуючи:
1) нітрозосполуки R-N=О;
 О
О

 2) нітросполуки R-N
2) нітросполуки R-N
О
3) аміни: первинні R-NН2
вторинні R-NН-R'
третинні R-N-R'
½
R''
4) діазосполуки ArN2X
5) азосполуки ArN2Ar'
6) азиди (алкіл- чи арілазіди) RN3
7) гідрозіни (алкіл чи арілгідрозіни) R-NН-NН2
8) деякі похідні карбонових кислот:
а) аміди R-СОО-NН2
б) нітрили R-С=N
в) азиди (ацилазіди) R-СОО-N3
г) гідрозіди (ацилгідрозіди) R-СОО-NН-NН2
9) сполуки зі змішаними функціями, такі як аміноспирти, амінофеноли, амінокислоти, нітрокислоти та ін.
Нітросполуки.
Нітросполуками називаються речовини, які містять у молекулі нітрогрупу (-NO2), азот якого пов'язаний з атомом вуглецю. У склад молекули органічної сполуки можуть входити одна або декілька нітрогруп. У залежності від будови радикалу, з яким пов'язана нітрогрупа, розрізняють аліфатичні, аліциклічні, ароматичні та гетероциклічні нітросполуки. Будова нітрогруп відрізняється рядом особливостей, які впливають на фізичні та хімічні властивості нітросполук. Атом азоту на своєму зовнішньому електронному рівні має чотири орбіталі, на яких можуть розташовуватися не більш восьми електронів. Тому формула нітрогрупи, як залишку

 О
О
 азотної кислоти, які містять десятиелектрону групіровку електронів у азоту - N,
азотної кислоти, які містять десятиелектрону групіровку електронів у азоту - N,
 О
О
не відповідає дійсності.
Для найменування нітросполук до назви відповідного вуглеводню додають префікс "нітро", наприклад:

Добування. Основним засобом добування нітросполук є реакція нітрування. Нітрування може проводитися азотною кислотою, нітрующую сумішшю (суміш азотної та сірчаної кислот), оксидами азоту. У залежності від будови даної речовини, умов нітрування, характерна нітрующого агента під час реакції виникає декілька різних продуктів. Загальна схема реакції має наступний вид:

 R - H R - NO2
R - H R - NO2
 чи нітрування чи
чи нітрування чи
Ar - H ArNO2
Нітрування алканів та циклоалканів може бути здійснено по реакції Коновалова чи у газовій фазі. Нітрування ароматичних сполук - є приклад реакції електрофільного заміщення.
Фізичні властивості. Нітросполуки жирного ряду - висококипящі рідини, з приємним запахом, мало або зовсім не розчинні у воді. Ароматичні нітросполуки - рідини чи тверді речовини, з запахом гіркого миндалю, ядовиті. Нітросполуки володіють великим електричним моментом диполя.
Хімічні властивості. Поновлення нітросполук. При поновленні нітросполук утворюються первинні аміни. Особливо велике промислове значення має відновлення ароматичних нітросполук:
 С6Н5NO2
С6Н5NO2  ® С6Н5NН2
® С6Н5NН2
нітробензол анілін
Дія лугів на нітросполуки. При введенні у молекулу вуглеводню нітрогрупа швидко підвищується рухомість атомів водню у a-положенні. Первинні та вторинні нітросполуки придбали здібність розчинятися у лугах з утворенням солей. При дії кислот утворюється нітросполука у аци-нітроформі, яка переходить у нітроформу:
a ¤¤ О ¤ ОNa

 R-CH2-N
R-CH2-N  R-CH=N ®O сіль аци-форми
R-CH=N ®O сіль аци-форми
O
нітросполука НСІ
 R-CH=N-ОН
R-CH=N-ОН
О
аци-нітроформа
Взаємоперетворення двох форм нітросполук є типічним прикладом динамічної ізомерії (таутомерія):
a ¤¤ О ¤ ОН

 R-CH2-N Û R-CH=N
R-CH2-N Û R-CH=N
О О
нітроформа аци-нітроформа
Дія азотистої кислоти на нітрування. При взаємодії первинних нітросполук з азотистою кислотою утворюються нітрилові кислоти, вторинних - псевдонітроли:

Третинні нітросполуки з азотистою кислотою не реагують.
Конденсація з альдегідами. Присутність рухомих a- водневих атомів у первинних та вторинних нітросполуках робить можливим їх конденсацію з альдегідами по альдольно-кротоновому типу:

Реакція бензольного ядра ароматичних нітросполук. Реакція заміщення у цьому випадку проходить складніше, ніж для самих вуглеводнів:

У присутності у бензольному ядрі декількох нітрогруп, вододіючих електроакцепторними властивостями, ядро у орто- та пара положеннях стає доступним для нуклеофільних реагентів:

Використання. Нітропарафіни використовуються у промисловості як розчинники, додаток до дизельного палева, понижуючий температуру їх загорання, при виробництві взривних речовин, пластмас, у реактивній техніці, як напівпродукт у синтезі амінів, альдегідів та кетонів, жирних кислот. Ароматичні нітросполуки - для до добування фарбників, пластмас та ін.
Аміни.
Амінами називаються органічні похідні аміаку, в якому один, два або всі три атоми водню заміщені на вуглеводні радикали (насичені, ненасичені, ароматичні).
Назви амінів будуть з назви вуглеводного радикала з додаванням закінчення –амін або з назви відповідного вуглеводню з префіксом аміно-. Приклади:

Залежно від числа атомів водню, заміщених в аміаку на вуглеводні радикали, розрізнюють первинні, вторинні і третинні аміни:

де  - вуглеводневі радикали.
- вуглеводневі радикали.
Первинні, вторинні і третинні аміни можна добути, здійснивши алкілування (введення алкільного радикала) аміаку. При цьому відбувається поступове заміщення атомів водню аміаку на радикали і утворюється суміш амінів:
NH3+CH3I  CH3NH2+HI
CH3NH2+HI
CH3NH2+CH3I  (CH3)2NH+HI
(CH3)2NH+HI
(CH3)2NH+CH3I  (CH3)3N+HI
(CH3)3N+HI
Звичайно в суміші амінів переважає один з них залежно від співвідношення вихідних речовин.
Для добування вторинних і третинних амінів можна використати реакцію амінів з галогеналкілами:

Аміни можна добути відновленням нітросполук. Звичайно нітросполуки піддають каталітичному гідруванню воднем:

Цей метод використовують у промисловості для добування ароматичних амінів.
Насичені аміни. За звичайних умов метиламін CH3NH2, диметиламін (СН3)2NН, триметиламін (СН3)3N та етиламін С2Н5NН2— гази з запахом, який нагадує запах аміаку. Ці аміни добре розчиняються у воді. Складніші аміни — рідини, вищі аміни— тверді речовини.
Для амінів характерні реакції приєднання, в результаті яких утворюються алкіламонійні солі. Наприклад, аміни приєднують галогеноводні:

Третинні аміни приєднують галагенопохідну вуглеводню з утворенням тетраалкїламонійних солей, наприклад:

Алкіламонійні солі розчинні у воді і в деяких органічних розчинниках. При цьому вони дисоціюють на іони:

В результаті водні і неводні розчини цих солей проводять електричний струм.
Хімічний зв'язок у алкіламонійних сполуках ковалентний, утворений за донорно-акцепторним механізмом (як і в іоні амонію):

Як і аміак, у водних розчинах аміни виявляють властивості основ. У їх розчинах з'являються гідроксид-іони за рахунок утворення алкіламонійних основ:

Лужну реакцію розчинів амінів можна виявити за допомогою індикаторів.
Аміни горять на повітрі з виділенням СО2, азоту і води, наприклад:

Первинні, вторинні і третинні аміни можна розрізнити, використовуючи азотисту кислоту НNО2. Під час взаємодії цієї кислоти з первинними амінами утворюється спирт і виділяється азот:

Вторинні аміни дають з азотистою кислотою нітрозо-сполуки, які мають характерний запах:

Третинні аміни не реагують з азотистою кислотою.
Анілін С6Н5NН2 є найважливішим ароматичним аміном. Це безбарвна оліїста рідина, яка кипить при температурі 184,4°С.
Анілін був уперше добутий у XIX ст. російським хіміком-органіком М.М.Зініним, який використав реакцію відновлення нітробензолу сульфідом амонію (NH4)2S У промисловості анілін добувають каталітичним гідруванням нітробензолу з використанням мідного каталізатора:

Старий спосіб відновлення нітробензолу, який втратив промислове значення, полягав у використанні заліза як відновника при наявності кислоти.
За хімічними властивостями анілін багато в чому аналогічний насиченим амінам, однак порівняно з ними є більш слабкою основою, що обумовлено впливом бензольного ядра. Вільна електронна пара атома азоту, з наявністю якої пов'язані основні властивості, частково втягується в  - електронну систему бензольного ядра:
- електронну систему бензольного ядра:

Зменшення електронної густини на атомі азоту знижує основні властивості ангіну. Анілін утворює солі лише з сильними кислотами. Наприклад, з хлороводневою кислотою він утворює хлорид феніламонію:

Азотиста кислота утворює з аніліном діазосполуки:

Діазосполуки, особливо ароматичні, мають велике значення в синтезі органічних барвників.
Деякі особливі властивості аніліну обумовлені наявністю в його молекулі ароматичного ядра. Так, анілін легко взаємодіє в розчинах з хлором і бромом, при цьому відбувається заміщення атомів водню в бензольному ядрі, які - перебувають в орто- і пара- положеннях відносно аміногрупи:

Анілін сульфується під час нагрівання з сірчаною кислотою, при цьому утворюється сульфанілова кислота:

Сульфанілова кислота — важливий проміжний продукт при синтезі барвників і лікарських препаратів.
Гідруванням аніліну при наявності каталізаторів можна добути циклогексиламін:

Анілін використовують у хімічній промисловості для синтезу багатьох органічних сполук, у тому числі барвників і ліків.
Амінокислоти
Амінокислоти — це органічні сполуки, до складу яких входять дві функціональні групи: карбоксильна— СООН і аміногрупа—NН2.
Назви амінокислот за замісниковою номенклатурою будують з назви кислоти з префіксом аміно-; положення аміногрупи зазначають цифрою звичайно прийнятим способом. Приклади:

Для амінокислот широко поширені раціональні назви. При побудові таких назв вуглецеві атоми молекулярного ланцюга позначають грецькими літерами( ), починаючи з атома вуглецю, сполученого з СООН-групою. Побудову таких назв можна спостерігати з таких прикладів:
), починаючи з атома вуглецю, сполученого з СООН-групою. Побудову таких назв можна спостерігати з таких прикладів:

Є амінокислоти, що містять дві або кілька аміногруп і карбоксильних груп, наприклад:

Властивості. Амінокислоти являють собою кристалічні речовини. Більшість амінокислот добре розчинні у воді.
Особливості хімічних властивостей цих сполук обумовлені одночасною наявністю в молекулах двох функціональних груп.
1. Утворення внутрішніх солей. Карбоксильна група, що входить до складу амінокислот, має кислотні властивості (може відщеплювати протон), аміногрупа — основні властивості (може приєднувати протон). За рахунок взаємодії цих двох груп амінокислоти можуть утворювати внутрішні солі, наприклад:

Ця властивість амінокислот пояснює причину відсутності кислої або лужної реакції розчинів цих сполук.
2. Утворення солей з лугами або кислотами. Амінокислотам властива амфотерність; вони можуть реагувати як з лугами, так і з неорганічними кислотами, утворюючи солі.
Наприклад, амінооцтова. кислота дає з лугами сіль, типову для кислот (заміна водню в гідроксильній групі на катіони металу), а в реакції з кислотою утворюється алкіламонійна сіль, характерна для амінів:

3. Утворення складних ефірів. Зі спиртами амінокислоти, як усі карбонові кислоти, утворюють складні ефіри, наприклад:

4. Декарбоксилування. Під час нагрівання амінокислот відбувається втрата ними карбоксильної групи і утворюються аміни:

5. Алкілування амінокислот. Як. і амін, амінокислоти можуть взаємодіяти з галагенопохідним вуглеводнів з поступовим заміщенням атомів водню в NН2-групі на алкільний радикал:

6. Утворення пептидів.  - амінокислоти можуть сполучатися одна з одною в результаті взаємодії карбоксильної групи і аміногрупи окремих молекул, наприклад:
- амінокислоти можуть сполучатися одна з одною в результаті взаємодії карбоксильної групи і аміногрупи окремих молекул, наприклад:

Сполука, яка утворюється, називається пептидом. Розрізняють дипептиди (молекула складається з двох залишків амінокислот), трипептиди (з трьох залишків амінокислот) і т. д., поліпептиди. Групу —СО—NН— називають пептидною.
Лекція №12
Тема:Аміноспирти.
Мета: Вивчити структурні формули найважливіших представників аміноспиртів, їх добування та застосування.
План:
1. Найважливіші представники аміноспиртів.
2. Найважливіші представники амінофенолів.
Аміноспирти. У молекулах аміноспиртів (оксиамінів) міститься два види функціональних груп – аміногрупа та гідроксильна група. Розрізняють аміноспирти та амінофеноли, у молекулі останніх оксі- аміногрупи пов’язані з атомом вуглецю бензольного ядра.
Із аміноспиртів велике значення має етаноламін (2-аміноетанол) та холін:
 СН3 +
СН3 +
|
НОСН2 – СН3 – NH2 НОСН2 – СН3 – N – CH3 ОН-
етаноламін |
(2-аміноетанол) СН3
холін
(гідроксид оксіетилтриметиламонію)
Етиламін отримують дією аміаку на гідроксид етилену, при цьому також утворюються ди- та триетаноламіни:





 О О О
О О О
Н2С – СН2 + NH3 " НОСН2 – СН2NH2  (НОСН2 – СН2)2NH
(НОСН2 – СН2)2NH 
оксид етилену етаноламін диетаноламін
" (НОСН2СН2)3N
триетаноламін
Етаноламіни – висококипячий, розчинні у воді рідини. Є структурними компонентами фосфоліпідів. Використовують в якості розчинників, поверхнево активних речовин, косметиці, для очистки газів від небажаних кислих компонентів (СО2, Н2S, НСN, НСІ).
(НОСН2СН2)3N + Н2S " (НОСН2СН2)3N × Н2S
Солі, які утворилися легко регенерують.
Інший важливий аміноспирт – це холін, який є четвертиною амонієвою основою. Холін широко розповсюджений у природі, входить до складу складних ліпідів. Він грає важливе значення у харчуванні та обміні речовин. Це гігроскопічна, безбарвна, кристалічна, добре розчинна у воді речовина. Холін використовують в якості компоненту комбікормів.
При обробці холіну оцтовим ангідридом утворюється ацетилхолін:
 О СН3
О СН3
|| |
СН3С – ОСН2 – СН2 – N– СН3 ОН-
|
СН3
якому виділяється важливе місце у передачі нервових збуджень.
При дегідратації холіну утворюється отруйний ненасичений амін – нейрин:
[СН2 = СН – N(СН3)3]+ [ОН]-
Процес відбувається при гниття білків.
Деякі аміноспирти – похідні бензолу, в який аміногрупа та гідроксил знаходиться у побічному ланцюгу, відносяться також до числа важливих фізіологічно активних речовин. Наприклад, ефедрин, який міститься у деяких видах рослин, використовують як лікарські засоби, які збуджують центральну нервову систему та звужують судини. В його молекулі є два різних асиметричних атоми вуглецю і тому він існує у виді чотирьох просторових ізомерів. У природі зустрічається лівообертаючий ізомер.



 –СНОН – СН – СН3
–СНОН – СН – СН3
|
NНСН3
Важлива роль в організмі людини та тварин приналежить аміноспирту адреналіну – гормону, який приймає участь у регулюванні серцевої діяльності та обмінних процесах.



 НО– –СНОН – СН2 – NНСН3
НО– –СНОН – СН2 – NНСН3
 НО
НО
Природний адреналін є лівообертаючий ізомер.
Амінофеноли. Амінофенолами називають ароматичні сполуки – похідні бензолу, які містять в ядрі гідроксил та аміногрупу. Найпростіший амінофенол має три ізомери:
ОН


 |
|


 ОН ОН
ОН ОН
NH2
1,2-або о -амінофенол | |
NH2 NH2
1,3- або м- амінофенол 1,4- або п -амінофенол
Добувають о – та п - амінофеноли, відновленням відповідних нітрофенолів, які легко утримуються при нітруванні фенолу. Синтез м - амінофенолу більш складний.
Дві електронодонорні групи, які в амінофенолах, підвищують електронну густину в ядрі, що призводить до збільшення його реакційної здібності. Легко окислююсь, амінофеноли діють на багато речовин як відновники. Наприклад, вони виділяють металеве срібло з його солей. Завдяки цьому амінофеноли використовують у фотографії у якості проявників. Для цього використовують метол (4-метиламінофенол) або амідол (2,4-диамінофенол):
ОН ОН

 | |
| |

 NН2
NН2
| |
NHСН3 NH2
метол амідол
Більш складні сполуки того ж типу є напівпродуктами у синтезі барвників. Особливо це відноситься до похідних нафталанового ряду. Багато похідних бензолу, які містять аміногрупу як в ядрі, так і в боковому ланцюгу, володіють фізіологічною активністю. Серед них лікарський препарат фенацетин – жарознижуючий засіб; синтетична солодка речовина дульцин (приблизно в 500 разів солодше цукру), по своїй будові є похідним сечовини; тирамін – отруйна речовина, яка міститься у грибі – паразит на житі, пшениці.
ОС2Н5 ОС2Н5 ОН


 | | |
| | |


 NН2
NН2
| | |
NH - СОСН3 NHСОNН2 СН2СН2NH2
фенацетин (1-етоксі-4- дульцин (4-етоксіфеніл- тирамін [b-(4-оксіфеніл)-
ацетиламінобензол) сечовина) етиламін]
Лекція № 13
Тема: Гетероциклічні сполуки.
Мета: Вивчити властивості гетероциклів, їх будову, добування та застосування.
План:
1. Шестичленні та пятичленні гетероцикли.
2. Класифікація гетероциклів.
3. Склад та номенклатура гетероциклів.
Гетероциклічними сполуками називаються речовини, у молекулі яких є цикли, які містять рядом з атомами вуглецю атоми інших елементів (гетероатоми).
Похідні гетероциклічних сполук мають фізіологічне значення; до них відносяться нуклеїнові кислоти, хлорофіл, ряд вітамінів, алкалоїди. Багато гетероциклічних сполук широко використовуються як лікарські препарати. Особливе значення мають сполуки, які містять у молекулі п'яти та шестичленні цикли, а також азот, кисень та сірку як гетероатоми. Ці атоми мають невеликий атомний об'єм, близькі до об'єму метиленової групи. У зв'язку з цим включення гетероатомів N, O, S замість груп -СН2- та -СН= у циклічну групіровку мало сказується на напруженні циклу та почти не змінює загальну геометрію молекули.
Гетероциклічні сполуки класифікують по числу атомів у циклі, а також по числу та індивідуальності гетероатому. У особливу групу виділяють гетероцикли з конденсированими ядрами.
При найменуванні гетероциклів використовують тривіальні назви, наприклад фуран, піридин, пиримідин, індол, хінолін та ін.:

Нумерація у гетероциклах завжди знаходиться з гетероатомами. Для простих систем можливі позначки положення за допомогою греческих букв: a (на ряду з гетероатомом) b та g (по мірі віддалення від гетероатому).
Властивості гетероциклів визначаються не тільки гетероатомами які є, но і залежать від характеру зв'язку у циклі. Гетероцикли, не які містять кратних зв'язків, як правило по хімічним та фізичним властивостям схожі на відповідні ацекличні сполуки.
Фуран, тіофен, пірол.
Будова. Вони є важливішими пятичленими гетероциклами з одним гетероатомом.

Відомо, що циклічна система володіє ароматичними властивостями лиш тоді, коли вона має плоску будову, (4 n + 2) делокалізованих p- електронів (правило Хюккеля) та має непереривний ланцюг.
З трьох елементів - кисень, азот та сірка - кисень більш електронегативний елемент. Зі зрівнянням з азотом кисень міцніше тримає свої електрони, значить у фурані пари неподілених електронів гетероатому слабкіші, чим у піролі. Добре виражений ароматичний характер тіофену його слабкою електронегативністю сірки (менша, чим електронегативність азоту та кисню).
Добування. Добування із 1,4-дікарбонілмістящих сполук. Це один із найбільш загальних засобів синтезу п'ятичленних ароматичних гетероциклів з одним гетероатомом. 1,4-Дікарбонільне сполучення може бути дікетоном, дікарбоновою кислотою чи кетокислотою. При нагріванні цих сполук з дегідратирующим агентом (СаСІ2, Н2SO4, P2O5 та ін.) утворюються похідні фурана; при проведенні дегідратації у середовищі аміаку - похідні піролу; у присутності фосфорних сполук сірки - похідні тіофену. Реакція дегідратації проходить, через утворення дієнолу:

Добуток фурану із слизової кислоти. При сухій перегонці слизової кислоти утворюється пірослизова кислота, при декарбоксилірованні якої (при нагріванні у запаяних трубках) маємо фуран:

Добуток фурану із фурфуролу. Фурфурол - найбільш доступне похідне фурану, добуте у промислових масштабах із сировини, багатого пентозанами. Гідролізом їх добувають з початку пентози, які потім проходять дегідратацію з циклізацією та перетворюються у фурфурол. Декарбонілірованієм фурфуролу добувають фуран:

Добуток тіофену у промисловості. Утворюється із бутану та парів сірки:

Добуток піролу із ацетилену та аміаку:

Взаємоперетворення фурану, тіофену та піролу. Між фураном, тіофеном та піролом є взаємозв'язок, відкритий вченим Ю.К. Юр’євим:

Ці перетворення названих гетероциклів друг у друга проходять при температурі 4500С у присутності триоксиду алюмінію.
Фізичні властивості. Фуран - безбарвна рідина, з запахом хлороформу. Тіофен - безбарвна рідина. Пірол - безбарвна рідина.
Хімічні властивості.
1. Р е а к ц і я е л е к т р о ф і л ь н о г о з а м і щ е н н я. Ці сполуки підвергаються нітруванню, сульфірованню, галогенірованню, ацилірованню та ін.. У всіх цих реакціях п'ятичленні гетероцикли ведуть себе активніше бензолу, нагадує своєю реакційною здібностью ароматичні аміни та феноли.
Галогеніровання. При бромуванні фурану на холоді, з початку відбувається приєднання молекули брому. Утворившаяся промежуточна речовина (яку не вдалося виділити) відщеплює молекулу бромної води та перетворюється у 2-бромфуран:

Для галогеніровання тіофену можна використовувати бром чи хлор при низькій температурі, при цьому можуть утворитися моно та полігалогентіофени. Найбільш дій сульфурил хлорид SO2Cl2:

При йодированні піролу утворюється тетрайодпіррол - йодол, який є добрим антисептиком. При дії сульфурилхлориду на холоді утворюється 2-хлорпіррол:

Сульфіровання. Фуран та пірол легші, чим тіофен, окислюються та осмолюються при дії мінеральних кислот. Осмоляюча дія кислот підтверджується тим, що з початку відбувається пронізація фурану по кисню:

При цьому пара електронів, які приймали участь у утворенні ароматичного секстету, виходить з подвійними зв'язками, ароматичність порушується і утворившийся оксієновий іон, який володіє властивостями дієна з подвійними зв'язками, легко полімеризується та засмолюється. Подібно веде себе і пірол. Тому сульфірування фуран та пірол вдається тільки пірідінсульфотріоксидом:


Підвищена стійкість тіофену дає можливість сульфіровати його сірчаною кислотою. По різності з бензолом він сульфітується на холоді:

Нітрування. Тіофен значно стійкий до дії мінеральних кислот, чим фуран та пірол, однак він все ж окислюється азотною кислотою з порушенням молекули. Так для нітрування тіофену, як і для нітрування фурану та піролу, використовують суміш оцтового ангідриду та азотної кислоти:

Ациліровання. Реакцію ациліровання по Фріделю-Крафтсу проводять у випадку фурану та піролу, використовуючи замість трихлориду алюмінію більш м’які каталізатори (SnCl2, SnCl4, ZnCl2, BF3):

2. Р е а к ц і ї г і д р і р о в а н і я. Гідрування фурану, тіофену та піролу приводить до насичених гетероциклічних систем, втративши ароматичні властивості. Фуран гідрується над нікелевим або платиновим каталізатором до тетрагідрофурану (ТГФ):

Тетрагідрофуран - цінний розчинник.
Тіофен повертається дією металевого натрію у аміаку чи спирті:

Тіофен та його гомологи містяться у сірчаних нафтах.
Електрохімічне повернення піролу може привести до продукту неповного гідрування - піроліну. Каталітичним поверненням у присутності нікелевого тапалладієвого каталізаторів можна добути піролідин:

Похідні піролу широко розповсюджені у природі, до їх числа відносяться такі важливі сполуки, як хлорофіл, гемоглобін, гетероциклічні амінокислоти, вітамін В12. Багато із цих сполук містяться у молекулі особливої групи із чотирьох пірольних ядер, називаємо ядром порфіна:

При заміщенні атомів водню у b- положенні пірольних кілець на радикали утворюється порфірин. Багато важливих природних сполук є металевими похідними порфіринів. Пігменти крові людини та тварини - гемоглобіни, містять атом заліза, є хромопротеїдами. Їх молекули складаються з двох частин - білкової частини (глобінів) та простатичної - гема:

Зелені пігменти рослин - хлорофіли, є маній похідними, у їх молекулі атоми азоту пов'язані з магнієм:

Хлорофілу належить роль у фотосинтезі - прийняття вуглекисневого газу зеленими рослинами за вдяки світовій енергії з утворенням органічної речовини. Фотосинтез є основним процесом утворення органічної речовини на Землі.
Лекція№ 14
Тема: Ліпіди.
Мета: Вивчити властивості ліпідів, їх класифікацію, добування та застосування.
План:
1. Ліпіди, їх класифікація.
Жири.
3. Складні ліпіди.
Ліпіди.
Ліпіди – це речовини, що входять до складу тваринних і рослинних тканин і є похідними вищих карбонових кислот, спиртів та інших сполук.
Ліпіди діляться на дві великі групи: прості і складні ліпіди. Прості ліпіди не містять азоту, фосфору і сірки. До них у першу чергу відносяться нейтральні ліпіди, які є похідними вищих жирних кислот і одно- чи багатоатомних спиртів. У склад складних ліпідів входять фосфоліпіди, сульфоліпіди, сфінголіпіди.
Жири.
Жири є різновидом класу природних органічних сполук, які називаються ліпідами. За хімічною будовою жири – складні ефіри гліцерину і вищих карбонових кислот. Їх називають також тригліцеридами.
Число вуглецевих атомів у кислотах, що входять до складу жирів, як правило, більше восьми (іноді менше). Приклади жирів:

Тригліцериди насичених кислот за звичайних умов є твердими речовинами, ненасичених кислот – оліїстими рідинами. У воді розчиняються мало.
Важливою хімічною властивістю жирів є їх здатність гідролізуватися, тобто вступати в реакцію омилення. Наприклад, під час омилення змішаного гліцериду, що містить залишки пальмітинової (C15H31COOH) і стеаринової (C17H35COOH) кислот, виділяються гліцерин і ці кислоти:

Омилення жирів відбувається необоротно при наявності лугів, при цьому утворюються гліцерин і сіль кислоти.
Жири широко поширені в природі, вони є складовою частиною рослинних і тваринних організмів. Тригліцериди можна добути за реакцією етерифікації, проте в промисловості їх виділяють переважно з природних речовин. У тваринних жирах переважають тригліцериди насичених кислот, тому ці жири за звичайних умов є твердими речовинами (наприклад, вершкове масло, свиняче сало). У рослинних жирах переважають тригліцериди ненасичених кислот, ці жири є рідинами (соняшникова олія, маслинова олія). Такі жири називаються оліями. У промисловості рідкі рослинні олії часто переробляють на тверді жири, які за властивостями нагадують тваринні. Для цього рослинні олії піддають каталітичному гідруванню, наприклад:

З гідрованих рослинних жирів виробляють важливий харчовий продукт – маргарин, який за хімічним складом аналогічний тваринним жирам.
Жири є важливою складовою частиною продуктів харчування людини і тварин. У процесі травлення відбувається гідроліз жирів, продукти гідролізу всмоктуються тканинами кишок. В організмі продукти гідролізу жирів знов утворюють потрібні жири. Жири в організмі людини і тварин постійно замінюються новими в процесі обміну речовин. Відпрацьовані жири поступово окислюються до вуглекислого газу і води.
Жири мають широке застосування в промисловості. Вони є вихідними речовинами для добування мила і гліцерину, використовуються для приготування мастил, косметичних засобів, розчинників олійних фарб – оліф.
Крім жирів до ліпідів належать возки – складні ефіри вищих карбонових кислот і вищих спиртів. Наприклад, воском є ефір цетилового спирту (C15H31CH2OH) і пальмітинової кислоти C15H31COOC15H31. Цей віск входить до складу бджолиного воску і речовини спермацету, що міститься в голові кита.
Лекція № 15
Тема: Вуглеводи. Глюкоза, фруктоза.
Мета: Вивчити структурні формули, класифікацію вуглеводів, добування та застосування вуглеводів.
План:
1. Класифікація вуглеводів.
2. Добування та застосування вуглеводів.
3. Властивості глюкози та фруктози.
Дата публикования: 2015-09-18; Прочитано: 2230 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
