 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Скорости прямой и обратной реакций. Равновесие. Константа равновесия. Термодинамический подход к рассмотрению равновесия
|
|
Теоретически все химические реакции в большей или меньшей степени обратимы, то есть могут в одних и тех же условиях протекать в противоположных направлениях. Обратимость реакций была доказана на следующем опыте: сначала смесь газов H2 и O2 пропускали через раскалённую железную трубку; при этом образовывалось некоторое количество водяных паров по реакции 2H2+O2→t 2H2O (пар). При пропускании же водяных паров через ту же трубку наблюдалось частичное разложение воды на кислород и водород: 2H2O (пар) →t 2H2+O2. То есть реакция между водородом и кислородом обратима: 2H2+O2↔t 2H2O (пар).
Обратимые реакции широко распространены и используются в химической технологии.
Обратимые реакции никогда не доходят до конца, то есть до полного исчезновения исходных реагентов и превращения их в продукты реакции. Пределом протекания обратимых реакций при заданных условиях является достижение состояние химического равновесия.
Истинное химическое равновесие характеризуется следующими признаками: 1) в момент равновесия скорости прямой и обратной реакций одинаковы (равны), то есть: Uпрям=Uобр (1), или k1 cA cB=k2cCcD (2) 2) химическое равновесие подвижно 3) к одному и тому же состоянию химического равновесия можно подойти с двух сторон: A+B K1↔K2 C+D (3) 4) в момент достижения равновесия запас свободной энергии системы является минимальным, а энтропия – максимальной.
Учитывая (1), (2) и (3) для равновесного состояния отношение двух постоянных k1 и k2 будет: k1/k2=cCcD/cAcB=k – величина, называемая константой химического равновесия. То есть для химического равновесия отношение произведения равновесных (мольных) концентраций продуктов к произведению равновесных (мольных) концентраций исходных веществ есть величина постоянная при постоянной температуре. Она показывает во сколько раз k1>k2 и зависит от природы реагирующих веществ (так как в формуле отношение концентраций). Для веществ в газообразном состоянии удобно использовать парциальные давления: kp=pCpD/pApB.
Под термином химическое сродство понимают способность веществ вступать в химическое взаимодействие друг с другом. Сродство веществ друг с другом могут характеризовать изменение термодинамических потенциалов ∆F и ∆G.
Для термодинамически обратимой реакции общего вида n1A+n2B↔n3C+n4D изменение термодинамических потенциалов и химическое сродство при T=const подсчитывают, используя соотношения, выведенные Вант-Гоффом и названные уравнениями изотермы химической реакции:
∆FT=RT(ln  -lnkC) (4); ∆GT=RT(ln
-lnkC) (4); ∆GT=RT(ln 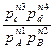 -lnkP) (5), где k – константы равновесия при температуре Т, с – концентрации, реагирующих веществ, n – их число молей, p – парциальные давления взаимодействующих газов. По этим уравнениям можно определить, в каком направлении, и до какого состояния равновесия может протекать реакция в нужном направлении. Если ∆FT и ∆GT имеют знак “-”, то реакция может протекать только в прямом направлении, и наоборот, если ∆FT=0 и ∆GT=0, то система достигла равновесного состояния. При концентрациях и давлениях равных единице, получим ∆F0T=-RTlnkC; или
-lnkP) (5), где k – константы равновесия при температуре Т, с – концентрации, реагирующих веществ, n – их число молей, p – парциальные давления взаимодействующих газов. По этим уравнениям можно определить, в каком направлении, и до какого состояния равновесия может протекать реакция в нужном направлении. Если ∆FT и ∆GT имеют знак “-”, то реакция может протекать только в прямом направлении, и наоборот, если ∆FT=0 и ∆GT=0, то система достигла равновесного состояния. При концентрациях и давлениях равных единице, получим ∆F0T=-RTlnkC; или
-∆F0T=2,303RTlgkC. Убыль величины изобарного потенциала рассчитывают по формуле: ∆G0T=2,303∆nRT lg1,0133*105-2,303RTlgkP (6), где ∆n – изменение числа молей газообразных веществ в реакции, равное алгебраической сумме: ∆n =n3+n4-n1-n2. По уравнениям (5 и 6), определив предварительно ∆GT (по таблице) можно определить константы равновесия kP и kC.
Дата публикования: 2015-09-18; Прочитано: 300 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
