 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Будова атома
|
|
Термін «атом», введений ще Демокритом, буквально означає – неподільний. Та наприкінці ХІХ століття з’явилися факти, які підтверджували складну будову атома. М.Фарадей під час вивчення законів електролізу у 1833 році зробив висновок про наявність у структурі атома електричних зарядів.
У 1897 році англійський фізик Дж. Томсон, вивчаючи електричний розряд у газах, відкрив електрон та виміряв його важливу характеристику – питомий заряд, що дорівнював 1,76.10-11 Кл/кГ.
Модель Томсона. Вчені не одразу вірно уявили собі будову атома. Першим свою модель запропонував Дж. Томсон.
За думкою Томсона, атом уявляв собою позитивно заряджену кулю радіусом R = 10-8см, всередині якої містяться електрони. Маса атома рівномірно розподілена по всьому його об’єму. Модель Томсона отримала назву «кексу з родзинками», де роль родзинок виконували електрони. Але така модель не відповідала даним експериментів з дослідження позитивного заряду атома, які були проведені Ернестом Резерфордом.
Досліди Резерфорда. Метою дослідів Резерфорда стала перевірка спроможності моделі Томсона. Якщо б модель, запропонована Томсоном була вірною, то під час пропускання пучка швидких α-частинок (ядер гелію) крізь досить тонку металічну плівку, експериментатори не повинні були спостерігати помітного їх відхилення від траєкторії.
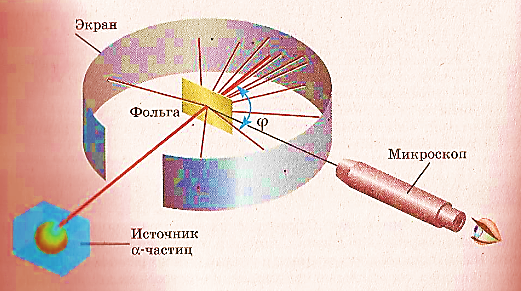 Схема досліду зображена на рисунку 1: α-частинки вилітали з джерела радіоактивного випромінювання, розміщеного у свинцевому контейнері, та проходили крізь золоту фольгу. Навколо фольги міг обертатися екран, який спалахував у місцях попадання α-частинок.
Схема досліду зображена на рисунку 1: α-частинки вилітали з джерела радіоактивного випромінювання, розміщеного у свинцевому контейнері, та проходили крізь золоту фольгу. Навколо фольги міг обертатися екран, який спалахував у місцях попадання α-частинок.
Рис. 1 Спалахи спостерігалися за допомогою мікроскопа. Резерфорд помітив, що деякі ядра гелію, пройшовши крізь фольгу, відхилялися на значні кути, а незначна кількість навіть відбивається назад. Основна ж кількість ядер проходила крізь фольгу так, ніби її там і не було.
На основі отриманих даних Резерфорд сформулював такі висновки:
- В центрі атома розташоване позитивно заряджене атомне ядро, діаметр якого ~ 10-15м. В ядрі зосереджена практично вся маса атома.
- Навколо ядра на досить великій відстані від нього обертаються негативно заряджені електрони (атом в основному пустотілий).
- Позитивний заряд ядра по модулю дорівнює добутку заряду електрона на порядковий номер хімічного елемента в таблиці Менделєєва.
- У цілому атом є електрично нейтральною системою.
Перелічені вище висновки Резерфорд взяв за основу запропонованої ним планетарної моделі (ядерної) моделі будови атома.
Незважаючи на те, що модель атома, запропонована Резерфордом, добре пояснювала дані, отримані під час експериментів, вона також мала протиріччя:
- Ядро атома заряджене позитивно, а електрони – негативно. Це означає, що між ними існує сила кулонівського перетягування. Тож, для того, щоб електрони не впали на ядро, вони повинні рухатися навколо нього з доцентровим прискоренням. За електродинамікою Максвелла, електричний заряд, що прискорено рухається, повинен неперервно випромінювати електромагнітні хвилі. Між тим, у нормальному стані атоми не випромінюють.
- Повсякденний дослід говорить про стабільність атомів. Але через випромінювання електромагнітних хвиль енергія електронів повинна була б весь час зменшуватися, і результатом такого процесу було б їх падіння на ядро. Розрахунки показують, що процес «падіння» тривав би всього 10-8с.
Насправді нічого подібного не відбувається. Атоми стійкі і у нормальному (не збудженому) стані можуть існувати безмежно довго, абсолютно не випромінюючи електромагнітні хвилі. До того ж, наприкінці ХІХ століття достатньо детально було досліджено спектри випромінювання та поглинання розжарених газів – лінійчаті спектри.
Висновок про обов’язкову загибель атома через втрату енергії на випромінювання, який ніяк не узгоджується з дослідом, - це результат застосування законів класичної фізики до явищ, що відбуваються всередині атома. Це наводить на думку про те, що до явищ атомних масштабів закони класичної фізики не підходять.
Спектри світла. Світло Сонця, лампи розжарювання, свічки розкладається призмою у суцільний (безперервний) спектр. Це говорить про те, що ці тіла випромінюють хвилі усіх можливих частот (довжин) хвиль. Для отримання безперервного спектра тіло потрібно нагріти до високої температури, після чого атоми речовини починають випромінювати світло.
Безперервні спектри визначаються не тільки випромінювальною властивістю атомів, але значною мірою залежать від взаємодії атомів один з одним, тому такі спектри дають тіла у твердому або рідкому стані, а також стиснуті гази.
Смугасті спектри складаються з окремих смуг, розділених темними проміжками. Кожна смуга складається з великої кількості щільно розташованих ліній. Смугасті спектри випромінюють молекули, не зв’язані або слабко зв’язані одна з одною: світіння пари в полум’ї або світіння газового розряду.
Лінійчаті спектри. Лінійчаті спектри випромінювання уявляють собою набір вузьких ліній різних кольорів. Вивчення таких спектрів для різних речовин показало, що кожен хімічний елемент має свій спектр, який не співпадає зі спектрами інших елементів. Лінійчаті спектри випромінювання хімічних елементів відрізняються кольором, положенням та кількістю окремих світлових ліній. З цього робимо висновок, що атом кожного хімічного елементу може випромінювати та поглинати тільки свій власний набір квантів визначеної енергії (наприклад, атом Гідрогену може випромінювати та поглинати у видимому діапазоні кванти фіолетового, синього, зеленого та червоного кольору).
Для того, щоб спостерігати світіння газу, його треба нагріти до високої температури, або пропускати крізь нього електричний струм. Якщо ж речовина знаходиться у твердому стані, то у полум’я горілки вносять її малесенькі купочки, або розчин. Випаровуючись, речовина дає лінійчатий спектр.
Лінійчатий спектр поглинання має вигляд темних ліній на тлі неперервного спектру. Розташування темних ліній співпадає з розташуванням кольорових ліній у спектрі випромінювання даного газу.
Спектральні прилади
(спектроскопи та спектрографи) – це прилади для дослідження спектрального складу електромагнітних випромінювань за довжинами хвиль, отримання спектральних характеристик випромінювачів та об’єктів, які взаємодіють з випромінюванням, а також спектрального аналізу.
Спектральний аналіз являє собою сукупність методів, які дозволяють за спектром речовини визначити, з яких елементів або молекул складається речовина, яка її будова, скільки домішок в ній міститься.
Оптичний спектр будь-якого атома (або іона) виключно індивідуальний, як відбитки пальців людини, тому сплутати його зі спектром іншого атома неможливо.
В результаті багатьох досліджень було створено атлас спектральних ліній всіх відомих атомів та їх іонів. За допомогою таких атласів проводиться ідентифікація складових речовини за її спектром. Кількісний вміст домішок елемента в речовині визначається за залежністю інтенсивності лінії випромінювання від його концентрації у досліджуваній речовині.
Постулати Бора. Вихід з вкрай складного положення з уявленнями про будову атома винайшов у 1913 році датський фізик Нільс Бор. Він пішов шляхом квантових уявлень про світло.
Послідовної теорії атома Бор не надав, але у вигляді постулатів сформулював основні положення нової теорії. Він не відкидав і закони класичної фізики також. Його постулати скоріше накладали деякі обмеження на рухи, що були можливі з точки зори класичної фізики. Постулати Бора склали основу квантової механіки.
Перший постулат Бора: Атомна система може знаходитися тільки в особливих стаціонарних (квантових) станах, кожному з яких відповідає енергія Еn; в стаціонарному стані атом не випромінює.
Дата публикования: 2015-09-17; Прочитано: 2351 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
