 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Предельные стационарные состояния проточных реакционных систем
|
|
Конечной целью функционирования любого химико-технологического процесса является получение целевых продуктов заданного качества. При этом основными технологическими показателями эффективности функционирования ХТС являются конверсия и селективность, максимально возможные значения которых для каждой конкретной схемы определяются объективно существующими термодинамическими ограничениями, наложенными как на процессы синтеза, так и на процессы разделения. Очевидно, что предельные значения указанных показателей будут зависеть от предельных возможностей каждого отдельного элемента ХТС.
В связи с этим, прежде всего возникает вопрос о предельно возможных значениях конверсии и селективности, достигаемых в основном элементе ХТС – химическом реакторе: аппарате, в котором осуществляются химические реакции с целью получения необходимых веществ в условиях технологического процесса.
При математическом описании гидродинамики проточных химических реакторов можно выделить два крайних гидродинамических режима, соответствующих математическим моделям идеального смешения и идеального вытеснения. На практике реальный гидродинамический режим находится между этими идеальными режимами и может лишь приближаться к ним в той или иной степени в зависимости от конструктивного оформления реактора и значений технологических параметров. В частности, режим идеального смешения может быть достаточно полно реализован в реакторе с мешалкой, а режим идеального вытеснения - в полом трубчатом реакторе при ламинарном течении жидкости или газа.
Основным допущением модели идеального смешения является допущение об отсутствии градиента по концентрации и температуре внутри реактора, в следствие чего математическая модель реактора идеального смешения в стационарном состоянии представляет собой систему алгебраических уравнений. В случае реактора идеального вытеснения необходимо учитывать изменение состава и температуры по длине реактора, что приводит к необходимости записи его математической модели в виде системы обыкновенных дифференциальных уравнений.
В силу простоты описания гидродинамического режима реактора идеального смешения, в дальнейшем при проведении анализа предельных стационарных состояний проточных реакционных систем будем использовать именно модель реактора идеального смешения.
Для ответа на вопрос о предельном значении конверсии в проточной реакционной системе рассмотрим простейший случай реактора идеального смешения (рис.1.1), в котором протекает единственная обратимая реакция типа АÛВ (реакция изомеризации).

Будем считать, что скорость реакции  подчиняется закону действующих масс
подчиняется закону действующих масс

| (1.1) |
где 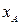 и
и 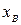 - мольные доли компонентов А и В соответственно,
- мольные доли компонентов А и В соответственно,  и
и  - константы скорости прямой и обратной реакции, значения которых будем полагать зафиксированными и не зависящими от условий проведения процесса.
- константы скорости прямой и обратной реакции, значения которых будем полагать зафиксированными и не зависящими от условий проведения процесса.
С учетом условия нормировки 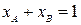 выражение (1.1) принимает вид
выражение (1.1) принимает вид

| (1.2) |
а скорость реакции  по компоненту А может быть записана как [9]
по компоненту А может быть записана как [9]

| (1.3) |
где 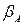 - стехиометрический коэффициент, относящийся к компоненту А, равный для данной реакции (-1).
- стехиометрический коэффициент, относящийся к компоненту А, равный для данной реакции (-1).
Для нахождения зависимости концентрации реагента А в реакторе от величины потока питания F и объема реактора V запишем (в соответствии с обозначениями на рис.1.1) материальный баланс реактора по компоненту А

| (1.4) |
где  - мольный поток на входе и выходе из реактора,
- мольный поток на входе и выходе из реактора, 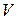 - реакционный объем,
- реакционный объем, 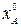 и
и 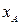 - концентрации реагента А на входе и выходе из реактора соответственно.
- концентрации реагента А на входе и выходе из реактора соответственно.
C учетом (1.3) уравнение (1.4) примет вид

| (1.5) |
откуда может быть получено выражение для концентрации реагента А на выходе из реактора

| (1.6) |
или после деления числителя и знаменателя правой части этого равенства на 
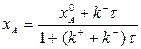
| (1.7) |
где  - время пребывания компонента в реакторе.
- время пребывания компонента в реакторе.
В частном случае, когда питание реактора состоит только из реагента А (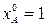 ), получим
), получим
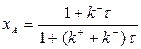
| (1.8) |
По определению значение конверсии  по компоненту А равно
по компоненту А равно

| (1.9) |
тогда с учетом (1.8) при 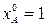 получим
получим

| (1.10) |
Допустим, что в системе достигнута полная конверсия, т.е. 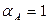 . Тогда из (1.10) следует, что
. Тогда из (1.10) следует, что

| (1.11) |
Так как все величины в (1.11) положительны, то это равенство никогда не выполнится и, следовательно, достижение в системе полной конверсии невозможно.
Найдем максимально возможное значение конверсии в системе, которое очевидно может быть достигнуто при бесконечном значении времени пребывания (или бесконечно большом объеме реакционной зоны).
Рассмотрим

| (1.12) |
Пренебрегая единицей в знаменателе, получим
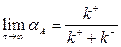
| (1.13) |
Таким образом, максимально возможное значение конверсии в системе равно

| (1.14) |
Из (1.9) следует, что при 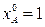
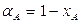
| (1.15) |
и, следовательно, концентрация в реакторе, соответствующая максимальной конверсии 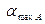 будет равна
будет равна
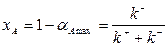
| (1.16) |
При достижении в системе химического равновесия скорость прямой реакции равна скорости обратной, т.е.

| (1.17) |
откуда следует, что химически равновесная концентрация реагента А равна
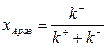
| (1.18) |
Таким образом, из (1.16) следует, что максимальное значение конверсии соответствует химически равновесным концентрациям в реакторе и достигается при бесконечно большом времени пребывания (в частности, при бесконечно большом объеме реактора).
В частном случае необратимой реакции, когда 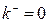 , а константа равновесия
, а константа равновесия 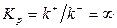 , из (1.14) следует, что
, из (1.14) следует, что
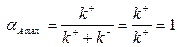
| (1.19) |
т.е.

| (1.20) |
Таким образом, в проточном реакторе идеального смешения максимально возможное значение конверсии достигается при бесконечно большом времени пребывания, а сама величина конверсии определяется химически равновесным составом. В случае необратимой реакции (равновесие полностью сдвинуто в сторону продуктов) теоретически возможно достижение полной конверсии при 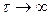 . Отсюда следует, что увеличение предельного значения конверсии, соответствующего химическому равновесию, возможно лишь за счет соответствующего выбора температуры и давления. Однако следует помнить, что при химическом взаимодействии в конденсированной фазе (жидкость или твердое тело) изменение давления не оказывает существенного влияния на химическое равновесие, а изменение температуры оказывает существенное влияние на химическое равновесие лишь при больших значениях теплового эффекта реакции.
. Отсюда следует, что увеличение предельного значения конверсии, соответствующего химическому равновесию, возможно лишь за счет соответствующего выбора температуры и давления. Однако следует помнить, что при химическом взаимодействии в конденсированной фазе (жидкость или твердое тело) изменение давления не оказывает существенного влияния на химическое равновесие, а изменение температуры оказывает существенное влияние на химическое равновесие лишь при больших значениях теплового эффекта реакции.
Необходимо отметить, что на практике время пребывания (или объем реакционной зоны) всегда является конечной величиной и, следовательно, конверсия в реакторе всегда будет меньше химически равновесной.
При анализе предельных стационарных состояний реакционных систем с селективным обменом веществом с окружающей средой, т.е. систем, в которых реактор является одним из элементов схемы, основным показателем его работы является не конверсия реагентов в нем, а его производительность Р [10], которую можно определить как:
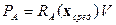
| (1.21) |
где 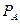 - производительность реактора по компоненту А (моль/сек),
- производительность реактора по компоненту А (моль/сек),  - скорость химической реакции по компоненту А, как функция от усредненного по объему реактора состава реакционной смеси
- скорость химической реакции по компоненту А, как функция от усредненного по объему реактора состава реакционной смеси  ,
,  - вектор, элементами которого являются усредненные концентрации соответствующих компонентов.
- вектор, элементами которого являются усредненные концентрации соответствующих компонентов.
 В случае реактора идеального смешения
В случае реактора идеального смешения  и тогда
и тогда
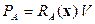
| (1.22) |
где  - вектор состава реакционной смеси.
- вектор состава реакционной смеси.
Найдем зависимость производительности реактора от его объема. Подставляя в (1.22) значение скорости из (1.3) получим

| (1.23) |
Далее, используя значение концентрации 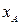 из уравнения (1.8), можно записать
из уравнения (1.8), можно записать
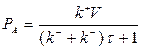
| (1.24) |
или с учетом того, что 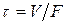
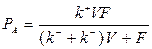
| (1.25) |
Таким образом, при фиксированных значениях 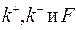 уравнение (1.25) задает зависимость производительности реактора от величины объема.
уравнение (1.25) задает зависимость производительности реактора от величины объема.
Из (1.25) следует, что при 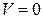 производительность реактора
производительность реактора  . Очевидно, что максимальная производительность достигается при
. Очевидно, что максимальная производительность достигается при  и равна
и равна
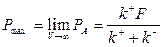
| (1.26) |
На (рис.1.2) представлена зависимость 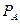 от величины объема реактора при фиксированных значениях
от величины объема реактора при фиксированных значениях  .
.
Условием полного превращения реагента А является равенство производительности реактора по реагенту А количеству этого реагента, поступающего в реактор, т.е.
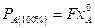
| (1.27) |
или для случая подачи чистого реагента А (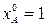 )
)
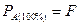
| (1.28) |
Сравним максимальную производительность реактора 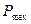 из (1.26) с производительностью
из (1.26) с производительностью 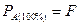 , необходимой для достижения полной конверсии.
, необходимой для достижения полной конверсии.
Для этого поделим числитель и знаменатель в (1.26) на 

| (1.29) |
Так как все величины в знаменателе (1.29) положительны, то можно утверждать, что

| (1.30) |
или
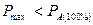
| (1.31) |
 Следовательно, максимально возможная производительность реактора всегда меньше производительности, необходимой для достижения полной конверсии.
Следовательно, максимально возможная производительность реактора всегда меньше производительности, необходимой для достижения полной конверсии.
Таким образом, еще раз показано, что в проточном реакторе достижение полной конверсии невозможно. Полученный результат является общим и справедлив для любого типа реакций и любого типа химического реактора.
Например, для реакции типа 2АÛВ+С максимально возможная конверсия будет соответствовать химически равновесным составам, принадлежащим линии химического равновесия, представленной в концентрационном треугольнике Гиббса (рис.1.3).
Каждая точка на такой линии химического равновесия соответствует составу (набору концентраций компонентов 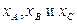 ), при котором скорость химической реакции
), при котором скорость химической реакции
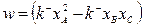
| (1.32) |
равна нулю. Как уже отмечалось выше, химическое равновесие, а, следовательно, и положение этой линии в концентрационном треугольнике определяется температурой и давлением.
В случае, когда химическое равновесие полностью смещено в сторону реагента, линия химического равновесия будет совпадать со сторонами треугольника АВ и АС. При полном смещении равновесия в сторону продуктов (практически необратимая реакция) линия химического равновесия будет совпадать со стороной ВС (рис.1.3).
Линия химического равновесия может рассматриваться как линия нулевой изоскорости. Очевидно, что в концентрационном треугольнике можно построить целое множество линий изоскоростей [11], каждая из которых будет отвечать своему постоянному значению скорости (рис. 1.3).
В соответствии с (1.32) максимальное значение скорости будет соответствовать случаю, когда в реакционной зоне находится только реагент А (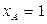 ), и в этом случае линия изоскорости вырождается в точку, соответствующую вер--шине треугольника А.
), и в этом случае линия изоскорости вырождается в точку, соответствующую вер--шине треугольника А.
 Так как производительность реактора равна произведению скорости химической реакции на объем реактора, то аналогичным образом в концентрационном треугольнике можно построить линии изопроизводительности.
Так как производительность реактора равна произведению скорости химической реакции на объем реактора, то аналогичным образом в концентрационном треугольнике можно построить линии изопроизводительности.
Каждая точ-ка на такой линии соответствует соста-ву х, при котором произведение скоро-сти расходования реагента А на объем V постоянно и равно заданной производительности. Эта линия совпадает с некоторой линией изоскорости химической реакции.
Очевидно, что все возможные составы в реакторе могут располагаться только на линии химического взаимодействия (ЛХВ), положение которой определяется стехиометрией реакции и составом потока питания.  . При изменении времени пребывания от нуля до бесконечности состав в реакторе будет перемещаться по линии химического взаимодействия от точки состава питания
. При изменении времени пребывания от нуля до бесконечности состав в реакторе будет перемещаться по линии химического взаимодействия от точки состава питания  (при
(при  ) до химически равновесного (точка пересечения ЛХВ с линией химического равновесия при
) до химически равновесного (точка пересечения ЛХВ с линией химического равновесия при  ).
).
 При фиксированном времени пребывания составы в реакторе в зависимости от состава питания будут располагаться на некоторой линии, как показано на рис. 1.4. Очевидно, что при
При фиксированном времени пребывания составы в реакторе в зависимости от состава питания будут располагаться на некоторой линии, как показано на рис. 1.4. Очевидно, что при 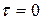 эта линия будет совпадать со сторонами треугольника АВ и АС, а при
эта линия будет совпадать со сторонами треугольника АВ и АС, а при  она будет совпадать с линией химического равновесия.
она будет совпадать с линией химического равновесия.
Аналогичные результаты по предельным возможностям проточных реакционных систем могут быть получены и для других гидродинамических режимов, т.е. в химических реакторах с любой гидродинамической структурой потоков и конечной величиной объема концентрации продуктов на выходе из реактора всегда ниже химически равновесных концентраций.
При этом максимальная производительность реактора достигается при бесконечно большом его объеме, однако она всегда меньше количества реагентов, поступающих в реактор в единицу времени.
Следовательно, для получения полной конверсии необходимо создать условия, позволяющие (при фиксированных значениях V, F и констант скоростей химической реакции) увеличивать производительность реактора (реакционной зоны) до некоторого заданного значения. Очевидно, что это возможно только за счет увеличения скорости химической реакции путем увеличения концентраций реагентов в реакционной зоне. Решение этой задачи возможно либо за счет уменьшения времени пребывания в реакционной зоне за счет дополнительного рециркуляционного потока (рециркуляционные процессы), либо за счет селективного вывода продуктов реакции непосредственно из реакционной зоны (совмещенные реакционно-массообменные процессы). Очевидно, что в том и другом случае необходима организация селективного обмена системы веществом с окружающей средой [12].
2. Селективный обмен веществом с окружающей средой – основной технологический принцип для создания ресурсо-
Дата публикования: 2015-09-17; Прочитано: 317 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
