 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Теоретичні відомості. Думку про існування критичної температури вперше висловив російський вчений Д.І
|
|
Думку про існування критичної температури вперше висловив російський вчений Д.І. Менделеєв у 1860 р. Він довів, що з підвищенням температури сили зчеплення між молекулами рідини зменшуються і за певного значення температури дорівнюють нулю, внаслідок чого рідина перетворюється в пару-газ без додаткової затрати теплоти. Критичною температурою речовини називають таку температуру, за якої зникає різниця між рідким і газоподібним станом, і вище від якої речовина може існувати тільки як газ. Теоретичною основою досліджень критичного стану речовини слугує рівняння Ван-дер-Ваальса для одного кіломоля реального газу:
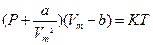 , (1)
, (1)
де Р – зовнішній тиск, що діє на газ (дорівнює тискові газу на стінки посудини);  - константа поправки на внутрішній тиск газу;
- константа поправки на внутрішній тиск газу; 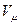 - об’єм кіломоля газу;
- об’єм кіломоля газу; 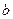 - константа поправки на власний об'єм усіх молекул даної маси газу;
- константа поправки на власний об'єм усіх молекул даної маси газу;  - універсальна газова стала;
- універсальна газова стала; 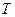 - абсолютна температура газу. Для різних газів константи Ван-дер-Ваальса
- абсолютна температура газу. Для різних газів константи Ван-дер-Ваальса  і
і 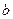 мають різне значення.
мають різне значення.

| Рис.15. |
Теоретичні та експериментальні графіки ізотерм реального газу зображені відповідно на рисунках 15( ,
, 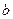 ). На початковому етапі стиску маємо справу з газом. Під час дальшого зменшення об’єму починається зрідження газу й на ділянці
). На початковому етапі стиску маємо справу з газом. Під час дальшого зменшення об’єму починається зрідження газу й на ділянці 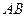 існують одночасно дві фази – газ і рідина, а починаючи від точки
існують одночасно дві фази – газ і рідина, а починаючи від точки 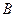 , маємо справу з рідиною, що малостислива. Під час підвищення температури горизонтальна ділянка ізотерми рис. 15 (б) стає вужчою і за деякої температури точки
, маємо справу з рідиною, що малостислива. Під час підвищення температури горизонтальна ділянка ізотерми рис. 15 (б) стає вужчою і за деякої температури точки 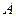 і
і 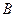 зливається в одну точку К (точка перегину), координати якої називають критичними параметрами даної речовини
зливається в одну точку К (точка перегину), координати якої називають критичними параметрами даної речовини 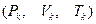 . Критичний тиск
. Критичний тиск 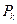 - це найбільше з можливих значення тиску насиченої пари даної речовини, а критичний об'єм
- це найбільше з можливих значення тиску насиченої пари даної речовини, а критичний об'єм 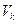 - максимальне значення об’єму, який може займати дана маса речовини у рідкому стані. Під час критичної температури
- максимальне значення об’єму, який може займати дана маса речовини у рідкому стані. Під час критичної температури  зникає різниця між рідиною та її парою, питома теплота пароутворення і коефіцієнт поверхневого натягу рідини дорівнюють нулю. Під час вищої температури за
зникає різниця між рідиною та її парою, питома теплота пароутворення і коефіцієнт поверхневого натягу рідини дорівнюють нулю. Під час вищої температури за  газ перетворити в рідину стискуванням неможливо, а за нижчих температур речовина може існувати залежно від тиску в усіх трьох фазах.
газ перетворити в рідину стискуванням неможливо, а за нижчих температур речовина може існувати залежно від тиску в усіх трьох фазах.
На основі рівняння (1) ми можемо виразити критичні параметри через константи Ван-дер-Ваальса. Для цього в рівнянні розкриємо дужки, звільнимось від знаменника, перенесемо всі члени в лівий бік й впорядкуємо їх за спаданням показника степеня при об'ємі:
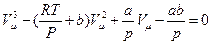 . (2)
. (2)
Для критичної точки рівняння набуде вигляду:
 . (3)
. (3)
Коренями рівняння є три дійсні і рівні значення для об’єму, що виконують умову:
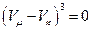 . (4)
. (4)
Піднісши ліву частину рівняння (4) до кубу й прирівнявши коефіцієнти за однакових степенів 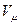 одержаного рівняння й рівняння (3), одержимо систему 3 рівнянь, з якої знайдемо значення для критичних параметрів:
одержаного рівняння й рівняння (3), одержимо систему 3 рівнянь, з якої знайдемо значення для критичних параметрів:
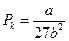 ;
; 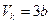 ;
; 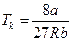 . (5)
. (5)
Важливі експериментальні дослідження критичних параметрів речовин, зокрема, критичних температур провів ще у 1873-1890 pp. професор Київського університету М. П. Авенаріус, на честь якого названо прилад для спостереження критичного стану ефіру.
Дата публикования: 2015-09-17; Прочитано: 272 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
