 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Загальні вказівки. При виконанні лабораторної роботи студенти повинні знати, що електроліти – це речовини, які розпадаються в розчинах або розплавах на позитивно заряджені іони
|
|
При виконанні лабораторної роботи студенти повинні знати, що електроліти – це речовини, які розпадаються в розчинах або розплавах на позитивно заряджені іони (катіони) і негативно заряджені іони (аніони). Процес розпаду молекул на іони – електролітична дисоціація – відбувається під дією полярних молекул розчинника. При цьому одні речовини розпадаються на іони повністю (сильні електроліти), а інші лише частково (слабкі електроліти).
До сильних електролітів належать майже всі солі, деякі мінеральні кислоти ( ) і основи, утворені лужними та лужноземельними металами (
) і основи, утворені лужними та лужноземельними металами (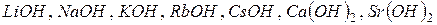
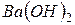 .
.
До слабких електролітів належать вода, практично всі органічні кислоти, деякі мінеральні кислоти (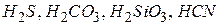 ), а також основи, утворенні
), а також основи, утворенні  - металами, та
- металами, та 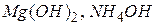 .
.
Здатність електролітів до дисоціації на іони визначається ступенем дисоціації 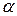 і константою дисоціації К.
і константою дисоціації К.
 ,
,
де  - число молекул, що розщепилися на іони;
- число молекул, що розщепилися на іони;
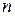 - загальне число розчинених молекул.
- загальне число розчинених молекул.
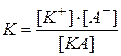 (для електроліту КА)
(для електроліту КА)
Необхідно звернути увагу на те, що більш універсальною характеристикою сили електроліту є константа дисоціації, оскільки К, як і 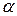 , залежить від природи розчиненої речовини і розчинника та від температури, але на відміну від
, залежить від природи розчиненої речовини і розчинника та від температури, але на відміну від 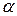 не залежить від концентрації розчину.
не залежить від концентрації розчину.
Слід мати на увазі, що багатоосновні кислоти і багатокислотні основи дисоціюють ступінчасто. Наприклад:
 /перший ступінь/
/перший ступінь/
 /другий ступінь/
/другий ступінь/
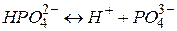 /третій ступінь/
/третій ступінь/
У водних розчинах електролітів необхідно враховувати дисоціацію води як слабкого електроліту:
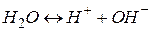
Іонний добуток води [ 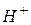 ] · [
] · [ 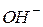 ] для будь-яких водних розчинів є постійною величиною, рівною 10 -14 (t =220C).
] для будь-яких водних розчинів є постійною величиною, рівною 10 -14 (t =220C).
Для характеристики реакції середовища доцільно користуватися водневим показником 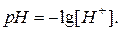 У нейтральних розчинах
У нейтральних розчинах 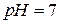 , в кислих
, в кислих 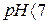 , у лужних
, у лужних 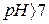 .
.
Для якісного визначення реакції середовища застосовують індикатори, колір яких змінюється в залежності від величини  розчину. Найчастіше використовують такі індикатори: лакмус, фенолфталеїн і метилоранж.
розчину. Найчастіше використовують такі індикатори: лакмус, фенолфталеїн і метилоранж.
Необхідно пам’ятати, що реакції обміну в розчинах електролітів практично відбуваються в бік утворення осаду (малорозчинних речовин), газів (летких речовин) і слабких електролітів (малодисоційованих сполук).
При складанні іонних рівнянь реакцій треба керуватися тим, що сильні розчинні електроліти, як практично повністю дисоційовані, пишуться у вигляді іонів, а речовини малодисоційовані, малорозчинні і газоподібні записують у молекулярній формі.
Дата публикования: 2015-09-18; Прочитано: 209 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
