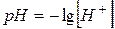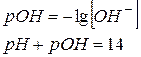| Електроліти
| - речовини, які в розчинах та розплавах розпадаються на іони, внаслідок чого їхні розчини та розплави проводять електричний струм.
|
| Електролітична дисоціація (або іонізація)
| - процес розщеплення електролітів на іони в середовищі полярних розчинників.
|
| Ступінь електролітичної дисоціації (α)
| - відношення числа молекул, які розщепилися на іони (N дис) до загального числа розчинених молекул (N):
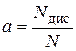
|
| Сильні електроліти
| - електроліти, які у розчинах практично повністю дисоціюють на іони; для них  . .
|
| Слабкі електроліти
| - електроліти, які під час розчинення у воді лише частково дисоціюють на іони, а основне число їхніх молекул перебуває в розчині в недисоційованому стані; для них  . .
|
| Кислоти
| - електроліти, що дисоціюють з відщепленням іонів  . .
|
| Основи
| - електроліти, що дисоціюють з відщепленням іонів 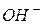 . .
|
| Амфотерні електроліти
| - електроліти, які дисоціюють і як кислоти, і як основи.
|
| Константа дисоціації (Кд)
| - константа рівноваги для оборотного процесу дисоціації слабкого електроліту
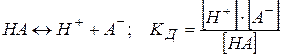 ,
де ,
де 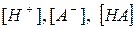 - рівноважні концентрації іонів та недисоційованих молекул слабкого електроліту. - рівноважні концентрації іонів та недисоційованих молекул слабкого електроліту.
|
| Закон розведення Оствальда
| - при розведенні розчинів слабких електролітів ступінь дисоціації збільшується
 або або 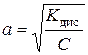
|
| Іонний добуток води
| - добуток концентрацій іонів  і і 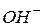
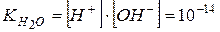 при t = 250C. при t = 250C.
|
| Водневий показник (рН)
| - від’ємний десятковий логарифм молярної концентрації іонів Н+ в розчині
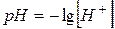
|
| Гідроксидний показник (рОН)
| - від’ємний десятковий логарифм молярної концентрації іонів 
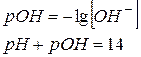
|
| Скорочені іонні рівняння
| - рівняння реакцій, в яких сильні розчинні електроліти записують у вигляді іонів, а слабкі розчинні електроліти, важкорозчинні та газоподібні речовини – у молекулярній формі.
|
| Гідроліз солей
| - реакція обмінної взаємодії між водою і розчиненими в ній солями, що супроводжується зміною рН середовища внаслідок утворення слабкої кислоти (її кислої солі) або слабкої основи (її основної солі).
|

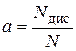
 .
.
 .
.
 .
.
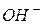 .
.
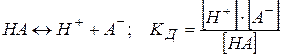 ,
де
,
де 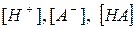 - рівноважні концентрації іонів та недисоційованих молекул слабкого електроліту.
- рівноважні концентрації іонів та недисоційованих молекул слабкого електроліту.
 або
або 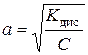
 і
і 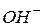
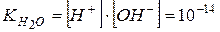 при t = 250C.
при t = 250C.