| Хімічна кінетика
| - розділ хімії, в якому вивчається швидкість перебігу хімічних реакцій, залежність швидкості від різних факторів і механізми хімічних процесів.
|
| Швидкість хімічної реакції (V)
| - зміна кількості речовини за одиницю часу в одиниці об’єму (для гомогенних реакцій) або на одиниці площі поверхні поділу фаз (для гетерогенних реакцій).
|
| Гомогенні реакції
| - реакції, які відбуваються в одній фазі.
|
| Гетерогенні реакції
| - реакції, які відбуваються на межі поділу фаз.
|
| Фактори, які визначають швидкість реакції
| - природа реагуючих речовин, їхня концентрація, тиск, температура, присутність каталізатора, властивості розчинника (для розчинів), площа поверхні дотику (для гетерогенних процесів).
|
| Закон діючих мас
| - швидкість хімічної реакції при сталій температурі пропорційна добутку концентрацій (С) реагуючих речовин у степенях, що дорівнюють стехіометричним коефіцієнтам. Для реакції 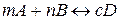 закон описується кінетичним рівнянням закон описується кінетичним рівнянням  . .
|
| Константа швидкості (k)
| - швидкість реакції за умови, що концентрації кожної з реагуючих речовин або їхній добуток дорівнюють 1 моль/л.
|
| Правило Вант-Гоффа
| - з підвищенням температури на кожні 100С (або 10К) швидкість більшості гомогенних реакцій збільшується у 2-4 рази.
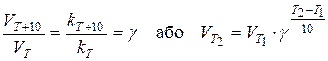 , де , де
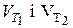 - швидкості реакції при температурах - швидкості реакції при температурах 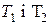 ;
γ – температурний коефіцієнт реакції, який показує, у скільки разів зростає швидкість реакції з підвищенням температури на 100С (або 10К). ;
γ – температурний коефіцієнт реакції, який показує, у скільки разів зростає швидкість реакції з підвищенням температури на 100С (або 10К).
|
| Оборотні реакції
| - реакції, які одночасно відбуваються у двох взаємно протилежних напрямках.
|
| Хімічна рівновага
| - стан системи, за якого швидкість прямої реакції дорівнює швидкості зворотної реакції.
|
| Константа хімічної рівноваги К
| - відношення константи швидкості прямої реакції kпр до константи швидкості зворотної реакції kзв, або відношення добутку рівноважних концентрацій продуктів реакції до добутку рівноважних концентрацій вихідних речовин у степенях, що дорівнюють їхнім стехіометричним коефіцієнтам: 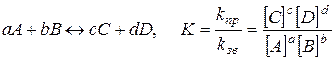 . .
|
| Зміщення хімічної рівноваги
| - перехід реакційної системи з одного стану рівноваги в інший.
|
| Принцип Ле Шательє
| - якщо умови, за яких система знаходиться в рівновазі змінити, рівновага зміщується в напрямку процесів, які протидіють цій зміні.
|

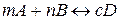 закон описується кінетичним рівнянням
закон описується кінетичним рівнянням  .
.
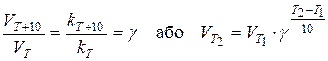 , де
, де
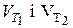 - швидкості реакції при температурах
- швидкості реакції при температурах 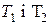 ;
γ – температурний коефіцієнт реакції, який показує, у скільки разів зростає швидкість реакції з підвищенням температури на 100С (або 10К).
;
γ – температурний коефіцієнт реакції, який показує, у скільки разів зростає швидкість реакції з підвищенням температури на 100С (або 10К).
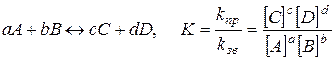 .
.
