| Моль
| - кількість речовини, яка містить 6,02·1023 структурних одиниць (молекул, атомів, іонів, електронів і т.і.).
|
| Молярна маса
| - маса одного моль речовини (кг/моль, г/моль)
ν=  , ν= , ν=  ,
де ν – кількість речовини, моль;
m – маса речовини, г;
M – молярна маса, г/моль;
V – об’єм газу, л;
VМ - молярний об’єм газу, л/моль. ,
де ν – кількість речовини, моль;
m – маса речовини, г;
M – молярна маса, г/моль;
V – об’єм газу, л;
VМ - молярний об’єм газу, л/моль.
|
| Еквівалент
| - реальна або умовна частинка, яка може заміщувати, приєднувати, звільняти чи якимось іншим чином відповідати одному іону водню Н+ в обмінних реакціях або одному електрону в окисно-відновних реакціях.
|
| Молярні маси еквівалентів елементів та складних речовин
| 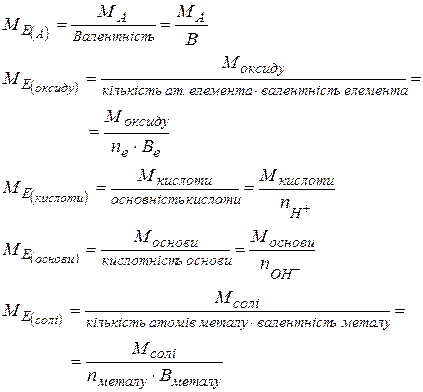
|
| Закон еквівалентів
| - маси реагуючих речовин відносяться між собою як молярні маси їхніх еквівалентів:
 або або 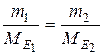
|
| Закон Авогадро
| - рівні об’єми різних газів за однакових умов (температура та тиск) містять однакову кількість молекул.
|
| Перший наслідок із закону Авогадро
| - один моль будь-якого ідеального газу (не враховуються міжмолекулярні взаємодії та розміри часточок) за певних умов (Р,Т) займає однаковий об’єм. За нормальних умов 1 моль будь-якого газу займає об’єм 22,4 л.
|
| Другий наслідок із закону Авогадро
|
- відношення мас рівних об’ємів різних газів за однакових температур дорівнює відношенню їхніх молярних мас:
 або або  ,
де ,
де 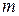 - маса газу, г;
М - молярна маса газу, г/моль; - маса газу, г;
М - молярна маса газу, г/моль;
 - відносна густина одного газу за другим. - відносна густина одного газу за другим.
|
| Число Авогадро (NА)
| - число структурних частинок, що містить у собі 1 моль речовини. 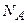 = 6,02·1023 моль-1. = 6,02·1023 моль-1.
|
| Закон Гей-Люссака
| - за сталого тиску об’єм даної маси газу змінюється прямо пропорційно температурі:  ,
де V - об’єм газу;
T – температура.
При постійному об’ємі: ,
де V - об’єм газу;
T – температура.
При постійному об’ємі: 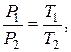 де Р - тиск газу.
де Р - тиск газу.
|
| Закон Бойля-Маріотта
| - за сталої температури об’єм даної маси газу змінюється обернено пропорційно тиску:
 де V -об’єм газу;
P - тиск.
де V -об’єм газу;
P - тиск.
|
| Об’єднаний закон Бойля-Маріотта і Гей-Люссака
|  де V - об’єм газу;
T – температура.
де V - об’єм газу;
T – температура.
|
| Рівняння Менделєєва-Клапейрона
| 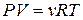 або або  ,
де v – кількість речовини газу;
m – маса газу;
V – об’єм газу;
M – молярна маса газу;
Р – тиск газу;
R –універсальна газова стала. ,
де v – кількість речовини газу;
m – маса газу;
V – об’єм газу;
M – молярна маса газу;
Р – тиск газу;
R –універсальна газова стала.

|
| Закон парціального тиску газів (закон Дальтона)
| - загальний тиск газової суміші дорівнює сумі парціальних тисків окремих газів, що утворюють суміш:
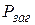 = Р1+Р 2 +Р3...,
де Рі – парціальний тиск і – того газу. = Р1+Р 2 +Р3...,
де Рі – парціальний тиск і – того газу.
|
| Парціальний тиск
| - це та частина загального тиску, яка припадає на долю даного газу.
|

 , ν=
, ν=  ,
де ν – кількість речовини, моль;
m – маса речовини, г;
M – молярна маса, г/моль;
V – об’єм газу, л;
VМ - молярний об’єм газу, л/моль.
,
де ν – кількість речовини, моль;
m – маса речовини, г;
M – молярна маса, г/моль;
V – об’єм газу, л;
VМ - молярний об’єм газу, л/моль.
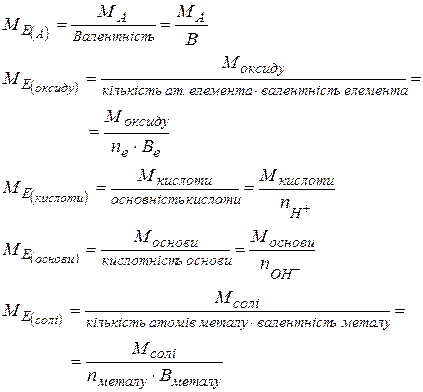
 або
або 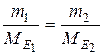
 або
або  ,
де
,
де 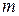 - маса газу, г;
М - молярна маса газу, г/моль;
- маса газу, г;
М - молярна маса газу, г/моль;
 - відносна густина одного газу за другим.
- відносна густина одного газу за другим.
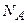 = 6,02·1023 моль-1.
= 6,02·1023 моль-1.
 ,
де V - об’єм газу;
T – температура.
При постійному об’ємі:
,
де V - об’єм газу;
T – температура.
При постійному об’ємі: 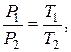 де Р - тиск газу.
де Р - тиск газу.
 де V -об’єм газу;
P - тиск.
де V -об’єм газу;
P - тиск.
 де V - об’єм газу;
T – температура.
де V - об’єм газу;
T – температура.
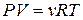 або
або  ,
де v – кількість речовини газу;
m – маса газу;
V – об’єм газу;
M – молярна маса газу;
Р – тиск газу;
R –універсальна газова стала.
,
де v – кількість речовини газу;
m – маса газу;
V – об’єм газу;
M – молярна маса газу;
Р – тиск газу;
R –універсальна газова стала.

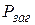 = Р1+Р 2 +Р3...,
де Рі – парціальний тиск і – того газу.
= Р1+Р 2 +Р3...,
де Рі – парціальний тиск і – того газу.