 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Образец билета модуля № 1
|
|
«Элементы общей химии. Поверхностные явления. Коллоидные системы»
Тестовая (первая) часть (25 тестов х 2 балла = 50 баллов)
(Выберите один правильный ответ)
1. Чему равна масса 2 моль-эквивалентов серной кислоты в реакции Н2SO4 + NaOH = NaНSO4 + Н2О?
а) 49 г б) 196 г в) 98 г г) 147 г
2. Что зависит от концентрации?
а) степень гидролиза б) константа скорости
в) константа диссоциации г) константа гидролиза
3. В перечне солей:
А) CaCl2; Б) CaOHCl; В) Ca(HSO4)2; Г) Ca(ClO)2; Д) Ca(CH3COO)2; Е) CaBr2
в водном растворе щелочную среду создают:
а) АБВ б) АВГ в) БДЕ г) БГД
4. рН раствора равен 12. Концентрации [H+] и [OH-] в этом растворе соответ-ственно равны (в моль/л):
а) 2×10−2 и 12×10−12 б) 1×10−12 и 1×10−2
в) 1×10−2 и 1×10−2 г) 1×102 и 1×1012
5. Растворение аммиака в воде:
а) увеличивает концентрацию ионов водорода
б) увеличивает концентрацию гидроксид-ионов
в) сопровождается изменением объема
г) не меняет соотношение концентрации ионов воды
6. Выражение ПР для малорастворимого соединения KtnAnm записывается в виде:
а) [Ktm+]m × [Ann−]n б) [Ktn m+] × [Ann−]m
в) [Ktm+]n × [Ann−]m г) [Ktm+] × [Ann−]
7. Карбонатный буфер выражается составом:
а) NaHCO3 + Na2CO3 б) Na2CO3 + К2CO3
в) NaHCO3 + (NH4)3PO4 г) NaHCO3 + KHCO3
8. Криометрия – это метод определения молекулярной массы растворенного вещества, основанный на измерении:
а) понижения температуры замерзания растворов
б) повышения температуры кипения растворов
в) понижения температуры кипения растворов
г) понижения давления насыщенного пара над раствором
9. При одинаковой моляльности температура замерзания будет наибольшей раствора, на основе:
а) воды (К = 1,86) б) бензола (К = 5,05)
в) циклогексана (К = 20,2) г) уксусной кислоты (К = 3,9)
10. Верны ли следующие утверждения?
А. В случае плазмолиза (экзосмоса) клетка становится вялой в результате перехода молекул воды из клетки.
Б. Действие солевых слабительных средств (сульфатов калия и натрия) связано с изменением осмотического давления в кишечнике.
а) верно только А б) верно только Б
в) верны оба суждения г) оба суждения не верны
11. Следствие из закона Гесса применительно к реакциям сгорания выражается уравнением:
а) DHр = SDHсгор. исх. в-в – SDHсгор. прод. реакции
б) DHр = SDHсгор. прод. реакции – SDHсгор. исх. в-в
в) DHр = SDHсгор. исх. в-в + SDHсгор. прод. реакции
г) DHр = SDHсгор. прод. реакции . SDHсгор. исх. в-в
12. Теплота образования 1 моль жидкой воды составляет 286 кДж. При взаимодействии 4 моль водорода с кислородом выделяется теплота количеством:
а) 572 кДж б) 715 кДж в) 858 кДж г) 1144 кДж
13. Гомогенной реакцией называют реакцию, которая протекает:
а) во всем объеме системы; б) на поверхности раздела фаз;
в) в водном растворе; г) в присутствии катализатора.
14. Скорость прямой реакции 2SO2(г) + O2(г) ® 2SO3(г) равна:
а) К. [SO2]2 ×[O2] б) К× [O2 ] в) К× [SO2]2 г) К× [SO3]2
15. При комнатной температуре с наибольшей скоростью протекает реакция:
а) 2Ba + O2 = 2BaO б) Ba2+ + CO32− = BaCO3
в) Ba + 2H+ = Ba2+ + H2 г) Ba + S = BaS
в) CO2(г) + 2C(тв) D 2CO(г) – Q г) 2NH3(г) D N2(г) + 3H2(г) – Q
16. Причиной поверхностных явлений служит:
а) особое состояние молекул вещества по всему объёму фазы;
б) особое состояние молекул в слоях, непосредственно прилегающих к поверхности раздела фаз;
в) одинаковое притяжение молекул вещества в объёме фазы;
г) одинаковое отталкивание молекул вещества в объёме фазы.
17. Для газов, растворов неэлектролитов и слабых электролитов адсорбция часто вычисляется по формуле:
а) 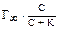

 б) K . С1/n в)
б) K . С1/n в)  г)
г) 
18. По теории адсорбции Фрейндлиха адсорбция возрастает:
а) без предела;
б) прямо пропорционально концентрации растворённого вещества;
в) до полного заполнения слоя, толщиной в одну молекулу;
г) до определенного максимального значения.
19. Укажите дисперсную систему, не относящуюся к аэрозолям:
а) туман; б) порошки; в) пемза; г) пыль; д) дым.
20. Смещение (сдвиг) частиц при броуновском движении зависит от:
а) вязкости дисперсионной среды; б) интенсивности движения частиц;
в) скорости движения частиц; г) всех перечисленных факторов.
21. Из перечисленных:
1) физического диспергирования; 2) физической конденсации;
3) химической конденсации; 4) ультрафильтрации
укажите метод, используя которого невозможно получить коллоидную систему:
а) 1 б) 2 в) 3 г) 4
22. В золях, кроме мицелл, стабилизатора и растворителя содержатся низкомолекулярные примеси. Последние снижают устойчивость коллоидных систем (нейтрализуют заряд коллоидных частиц, вызывают коагуляцию и разрушение коллоидных систем). В связи с этим коллоидные системы очищают. С этой целью может быть использован:
а) электрофорез; б) нефелометрия; в) ультрамикроскопия; г) диализ;
23. Единицей измерения электрофоретической подвижности служит:
а) м2/В . с; б) м2/В; в) В . с; г) В/м2. с
24. Коагуляцией называется процесс:
а) осаждения частиц под действием силы тяжести;
б) объединения коллоидных частиц с последующим осаждением;
в) перемещения коллоидных частиц к противоположно заряженному электроду;
г) очищения коллоидных растворов.
25. Золь, мицелла которого выражается формулой
{zFe(OH)3,nFeO+,(n-x) Cl-}x Cl- коагулирует под действием электролита:
а) FeCl3; б) FeCl2; в) FeOCl; г) NaCl;
Творческие задания (5 заданий х 10 = 50 баллов)
1. В растворе содержатся сульфат-, хромат- и оксалат-ионы с концентрацией 1.10−3 моль/л. В этот раствор по каплям внесли раствор хлорида стронция до концентрации этой соли до 1.10−3 моль/л. На основе расчетов докажите возможность выпадения солей в осадок и их последовательность осаждения. ПР[SrSO4] = 3,2.10−7; ПР[SrCrO4] = 3,6.10−5; ПР[SrC2O4] = 5,6.10−8.
2. Классификация буферных растворов. В каких объемах нужно смешать растворы уксусной кислоты и ацетата натрия с одинаковой молярной концентрацией, чтобы приготовить 100 мл буферного раствора с рН = 5? pK(СН3СООН) = 4,74.
3. Девушка, строго «соблюдающая фигуру», съела шоколада в два раза больше её ежедневной нормы (220 ккал). Чтобы ликвидировать энергетические излишества, сколько часов ей придётся ездить на велосипеде (920 кДж/ч)? (1кал = 4,18 Дж).
4. При уменьшении концентрации новокаина в растворе с 0,2 М до 0,15М поверхностное натяжение возросло с 6,9 . 10-2 Дж/м2 до 7,1 . 10-2Дж/м2, а в случае растворов кокаина с 6,5 . 10-2 Дж/м2 до 7 . 10-2 Дж/м2. Сравните величины адсорбции при 293 K двух веществ в данном интервале концентраций.
5. Как классифицируют дисперсные и коллоидные системы?
Дата публикования: 2015-09-18; Прочитано: 655 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
