 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Ход работы. В данной лабораторной работе в качестве адсорбента используют активированный уголь, а в качестве адсорбтива – уксусную кислоту
|
|
В данной лабораторной работе в качестве адсорбента используют активированный уголь, а в качестве адсорбтива – уксусную кислоту. Определение концентрации CH3COOH в растворе до и после адсорбции проводят методом алкалиметрического титрования раствором гидроксида натрия в присутствии фенолфталеина.
Сначала готовят растворы уксусной кислоты разной концентрации разбавлением 0,1 н раствора дистиллированной водой в мерных колбах на 100 мл в соответствии с указаниями, приведенными в таблице 2.1.
Таблица 2.1
| Номер колбы | ||||||||||
| Объем 0,1 н раствора CH3COOH, мл | ||||||||||
| Объем дистиллированной воды, мл | - | |||||||||
| Примерная концентрация разбавленного раствора, моль/л | 0,008 | 0,015 | 0,02 | 0,025 | 0,03 | 0,035 | 0,04 | 0,045 | 0,05 | 0,1 |
Затем в десять пронумерованных конических колб последовательно наливают по 50 мл раствора уксусной кислоты разной концентрации и вносят по
1 г предварительно измельченного активированного угля. Растворы с адсорбентом выдерживают в течение 45 минут при постоянном перемешивании до достижения адсорбционного равновесия.
После окончания адсорбции растворы фильтруют и определяют равновесную концентрацию уксусной кислоты. Для этого в колбу для титрования мерной пипеткой отбирают 20 мл первого раствора, добавляют 2-3 капли фенолфталеина и титруют раствором NaOH до появления неисчезающей малиновой окраски. Процедуру повторяют с остальными растворами CH3COOH. (Внимание! Растворы с ориентировочными концентрациями уксусной кислоты 0,001-0,01 моль/л титруют 0,01 н, а свыше 0,01 моль/л – 0,1 н раствором NaOH).
Параллельно с проведением адсорбции определяют точную концентрацию исходных растворов уксусной кислоты методом алкалиметрического титрования в присутствии фенолфталеина по приведенной выше методике. Концентрация раствора NaOH, используемого для титрования, также определяется ориентировочной концентрацией исходного раствора CH3COOH.
Концентрацию кислоты до и после адсорбции, в моль/л, вычисляют по формуле (2.6):
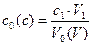 (2.6)
(2.6)
где 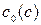 - концентрация уксусной кислоты до (после) адсорбции, моль/л;
- концентрация уксусной кислоты до (после) адсорбции, моль/л;
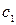 - нормальная концентрация раствора гидроксида натрия, моль/л;
- нормальная концентрация раствора гидроксида натрия, моль/л;
 - объем раствора гидроксида натрия, пошедший на титрование, мл;
- объем раствора гидроксида натрия, пошедший на титрование, мл;
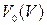 - объем раствора уксусной кислоты, отобранный для титрования, мл.
- объем раствора уксусной кислоты, отобранный для титрования, мл.
Величину абсолютной адсорбции  , в моль/кг, рассчитывают по формуле (2.7):
, в моль/кг, рассчитывают по формуле (2.7):
 (2.7)
(2.7)
где  и
и 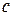 - концентрации вещества в объеме раствора до и после адсорбции, моль/л;
- концентрации вещества в объеме раствора до и после адсорбции, моль/л;
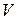 - объем раствора кислоты, взятый для проведения адсорбции, л;
- объем раствора кислоты, взятый для проведения адсорбции, л;
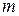 - масса адсорбента, кг.
- масса адсорбента, кг.
Экспериментальные и расчетные данные заносят в таблицу 2.2.
Таблица 2.2
| Номер колбы | ||||||||||
| Объем NaOH, пошедший на титрование до адсорбции, мл | ||||||||||
| Концентрация раствора NaOH, использованного для титрования, моль/л | ||||||||||
| Концентрация уксусной кислоты до адсорбции, моль/л | ||||||||||
| Объем NaOH, пошедший на титрование после адсорбции, мл | ||||||||||
| Концентрация раствора NaOH, использованного для титрования, моль/л | ||||||||||
Равновесная концентрация уксусной кислоты после адсорбции ( ), моль/л ), моль/л
| ||||||||||
Абсолютная адсорбция ( ), моль/кг ), моль/кг
|
Строят изотерму адсорбции, откладывая по оси абсцисс равновесную концентрацию CH3COOH, а по оси ординат – величину абсолютной адсорбции. По полученному графику находят величину предельной адсорбции.
Проверка применимости уравнений Фрейндлиха и Ленгмюра для описания адсорбционного равновесия
Возможность применения того или иного уравнения для описания адсорбционного равновесия определяется тем, насколько адекватно уравнение может описать полученные экспериментальные данные. Для этого результаты экспериментов представляют в соответствующем линеаризованном виде.
Логарифмированием уравнения Фрейндлиха, получаем следующее выражение (2.8):
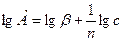 (2.8)
(2.8)
В случае адекватности уравнения Фрейндлиха при описании полученной экспериментальной зависимости точки на графике функции 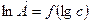 должны лежать на одной прямой. Как правило, такому условию отвечает лишь часть экспериментальных данных, приходящихся на криволинейный участок изотермы адсорбции.
должны лежать на одной прямой. Как правило, такому условию отвечает лишь часть экспериментальных данных, приходящихся на криволинейный участок изотермы адсорбции.
Из выражения (2.8) следует, что тангенс угла наклона прямой в координатах 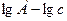 к положительному направлению оси абсцисс соответствует величине
к положительному направлению оси абсцисс соответствует величине  , а отсекаемый ею отрезок на оси ординат -
, а отсекаемый ею отрезок на оси ординат -  (рисунок 2.2):
(рисунок 2.2):

Рисунок 2.2 – Изотерма адсорбции в логарифмических координатах
Значения предельной адсорбции и константы адсорбционного равновесия может быть найдена путем линеаризации уравнения Ленгмюра:
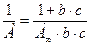
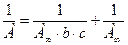 (2.9)
(2.9)
Тангенс угла наклона прямой к положительному направлению оси абсцисс в координатах  равен
равен  , а отрезок, отсекаемый прямой на оси ординат, соответствует величине
, а отрезок, отсекаемый прямой на оси ординат, соответствует величине 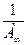 (рисунок 2.3):
(рисунок 2.3):

Рисунок 2.3 – Определение предельной адсорбции и константы адсорбционного равновесия графическим методом
Для выполнения анализа проводят необходимые расчеты, заполняют таблицу 2.3, строят графики функций  и
и  и определяют постоянные величины уравнений Фрейндлиха и Ленгмюра.
и определяют постоянные величины уравнений Фрейндлиха и Ленгмюра.
Таблица 2.3
| с, моль/л |  , моль/кг , моль/кг
| 
| 
| 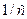 , л/моль , л/моль
| 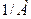 , кг/моль , кг/моль
|
Используя полученные уравнения рассчитывают значения абсолютной адсорбции и сравнивают их с экспериментальными (таблица 2.4).
Таблица 2.4
| с, моль/л |  , моль/кг , моль/кг
| ||
| определенная экспериментально | рассчитанная по уравнению | ||
| Фрейндлиха | Ленгмюра | ||
Делают вывод о возможности применения уравнений Фрейндлиха и Ленгмюра для описания результатов проведенной серии экспериментов.
Список вопросов для отчета лабораторной работы.
1. Различия между физической и химической адсорбцией.
2. Основные понятия: адсорбция, абсорбция, десорбция, адсорбент, адсорбат, адсорбтив.
3. Способы выражения адсорбции.
4. Изотерма мономолекулярной адсорбции. Предельная адсорбция.
5. Теория мономолекулярной адсорбции. Уравнения Ленгмюра, Генри, Фрейндлиха.
6. Определение постоянных величин в уравнениях Фрейндлиха и Ленгмюра.
7. Правила молекулярной адсорбции из растворов на твердых адсорбентах.
8. Полимолекулярная адсорбция. Изотерма полимолекулярной адсорбции. Теория БЭТ.
Дата публикования: 2015-07-22; Прочитано: 496 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
