 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Изучение адсорбции на границе твердое тело – жидкость
|
|
Лабораторная работа №2.
Цель работы: изучение адсорбции вещества из водного раствора на твердом адсорбенте и расчет удельной поверхности адсорбента.
Приборы и реактивы: водные растворы уксусной кислоты разной концентрации, 0,01 н и 0,1 н растворы гидроксида натрия, активированный уголь, бумажные фильтры, воронки, конические колбы, бюретка для титрования.
Адсорбция – наиболее распространенное поверхностное явление, которое чаще всего заключается в увеличении концентрации вещества в поверхностном слое по сравнению с объемом фазы. Для описания адсорбции могут быть использованы две величины: абсолютная адсорбция 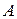 - количество вещества в поверхностном слое, приходящееся на единицу поверхности или массы адсорбента, и гиббсовская адсорбция
- количество вещества в поверхностном слое, приходящееся на единицу поверхности или массы адсорбента, и гиббсовская адсорбция 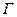 - избыток веществ в поверхностном слое на единицу поверхности по сравнению с его концентрацией в объеме фазы. При резко выраженной способности вещества к адсорбции и его малой объемной концентрации эти величины оказываются примерно равными, т.е.
- избыток веществ в поверхностном слое на единицу поверхности по сравнению с его концентрацией в объеме фазы. При резко выраженной способности вещества к адсорбции и его малой объемной концентрации эти величины оказываются примерно равными, т.е. 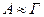 .
.
Зависимость адсорбции от равновесной концентрации адсорбтива при постоянной температуре носит название изотермы адсорбции.
Несмотря на то, что фундаментальное (общее) уравнение Гиббса
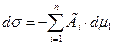 (2.1)
(2.1)
применимо к процессу адсорбции на любых границах раздела фаз, его использование на практике ограничено сложностью экспериментального определения ряда величин, прежде всего – поверхностного натяжения. Для целей аналитического описания адсорбции предложено большое количество моделей (математических выражений), адекватность которых в каждом конкретном случае определяется рядом критериев:
1 уравнение должно правильно отражать характер зависимости величины адсорбции от содержания адсорбтива в состоянии адсорбционного равновесия;
2 вычисленные с использованием уравнения постоянные величины должны быть правдоподобны;
3 используемая теория должна правильно отражать температурную зависимость адсорбции.
Часто для описания адсорбции с образованием мономолекулярного адсорбционного слоя (т.е. слоя толщиной в одну молекулу) используют теорию Ленгмюра, основные положения которой заключаются в следующем:
1 адсорбция протекает на активных центрах за счет физических сил;
2 каждый активный центр удерживает только одну молекулу, которая неспособна перемещаться по поверхности;
3 молекулы адсорбционного слоя не взаимодействуют друг с другом.
Изотерма мономолекулярной абсорбции в широком интервале концентраций может быть описана уравнением:
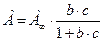 - для растворов,
- для растворов,
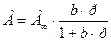 - для паров, (2.2)
- для паров, (2.2)
где 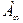 - емкость мономолекулярного слоя или предельная величина адсорбции, представляющая собой число молей вещества, приходящихся на единицу поверхности в насыщенном адсорбционном слое;
- емкость мономолекулярного слоя или предельная величина адсорбции, представляющая собой число молей вещества, приходящихся на единицу поверхности в насыщенном адсорбционном слое;
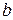 - константа адсорбционного равновесия;
- константа адсорбционного равновесия;
 - равновесная концентрация адсорбтива в объеме фазы;
- равновесная концентрация адсорбтива в объеме фазы;
 - равновесное давление паров адсорбтива в объеме фазы.
- равновесное давление паров адсорбтива в объеме фазы.
На рисунке 2.1 приведена ленгмюровская изотерма адсорбции.
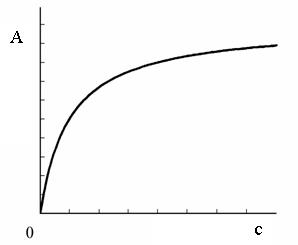
Рисунок 2.1 – Изотерма мономолекулярной адсорбции
В области низких концентраций (при 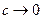 ) можно допустить, что
) можно допустить, что 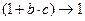 , поэтому уравнение Ленгмюра приобретает вид
, поэтому уравнение Ленгмюра приобретает вид 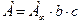 . Произведение двух постоянных величин
. Произведение двух постоянных величин  также является постоянным и носит название константы Генри (
также является постоянным и носит название константы Генри ( ), а уравнение вида
), а уравнение вида 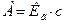 - уравнения Генри. Участок изотермы адсорбции, описываемый уравнением Генри, представляет собой прямой отрезок, проходящий через начало координат.
- уравнения Генри. Участок изотермы адсорбции, описываемый уравнением Генри, представляет собой прямой отрезок, проходящий через начало координат.
В области высоких концентраций (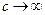 ) дробь
) дробь 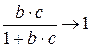 , а уравнение Ленгмюра имеет вид
, а уравнение Ленгмюра имеет вид  , что соответствует насыщению поверхностного слоя. Участок изотермы адсорбции, отвечающий такому состоянию, представляет собой прямую, параллельную оси абсцисс (оси концентраций).
, что соответствует насыщению поверхностного слоя. Участок изотермы адсорбции, отвечающий такому состоянию, представляет собой прямую, параллельную оси абсцисс (оси концентраций).
Часто процесс адсорбции на границе твердое тело-жидкость или твердое тело-газ может быть описан эмпирическим уравнением Фрейндлиха  , которому на графике
, которому на графике 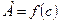 соответствует криволинейный участок.
соответствует криволинейный участок.
Величина 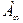 позволяет определить такие характеристики, как площадь (посадочную площадку)
позволяет определить такие характеристики, как площадь (посадочную площадку)  адсорбирующейся молекулы, толщину адсорбционного слоя, определяемого длиной адсорбирующейся молекулы, а также удельную поверхность адсорбента
адсорбирующейся молекулы, толщину адсорбционного слоя, определяемого длиной адсорбирующейся молекулы, а также удельную поверхность адсорбента  по уравнениям (2.3), (2.4) и (2.5) соответственно:
по уравнениям (2.3), (2.4) и (2.5) соответственно:
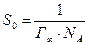 (2.3)
(2.3)
 (2.4)
(2.4)
 (2.5)
(2.5)
Дата публикования: 2015-07-22; Прочитано: 1094 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
