 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Обратное титрование, метод замещения
|
|
121 Азот из навески органического вещества массой 1,000 г с помощью концентрированной серной кислоты переведен в (NH4)2SO4. При кипячении соли с концентрированной щелочью выделившийся аммиак поглощен 50,00 см3 0,1500 М (1/2 H2SO4). На обратное титрование затрачено 12,00 см3 раствора 0,09980 М NaOH. Вычислить массовую долю азота в навеске.
122 Навеску карбоната натрия массой 0,1054 г обработали 25,00 см3 0,2000 М HCl; избыток кислоты оттитровали 25,40 см3 0,1200 М NaOH. Вычислить массовую долю Na2CO3.
123 Вычислить величину навески химически чистого CaCO3, если после обработки ее 50,00 см3 0,2000 М раствора HCl. На титрование остатка кислоты израсходовано 10,00 см3 раствора NaOH. Установлено, что на титрование 25,00 см3 NaOH расходуется 24,00 см3 HCl.
124 Навеску 1,500 г технического (NH4)2SO4 растворили в мерной колбе вместимостью 250,00 см3; 25,00 см3 этого раствора прокипятили с концентрированной щелочью. При этом выделившийся аммиак поглощен 50,00 см3 0,1500 М (1/2 H2SO4). На обратное титрование израсходовано 25,00 см3 раствора 0,0970 М NaOH. Вычислить массовую долю аммиака в навеске (NH4)2SO4.
125 Навеска 1,6160 г технического сульфата аммония для определения содержания в нем NH3 растворена в мерной колбе на 250,0 см3. При кипячении 25,00 см3 полученного раствора с концентрацией NaOH выделившийся аммиак поглощен 40,00 см3 0,1020 М (1/2 (NH4)2SO4), а избыток кислоты оттитрован 0,0960 М. NaOH. На обратное титрование израсходовано 17,00 см3 NaOH. Вычислить % NH3 в техническом образце.
126 Пробу массой 0,816 г, содержащую диметилфталат (C6H4(COOCH3)2 (M = 194 г/моль) и неактивные компоненты, разложили кипячением с 50,00 см3 0,1030 М NaOH. По окончании реакции на титрование избытка гидроксида натрия израсходовали 24,20 см3 0,164 М HCl. Рассчитайте процентное содержание диметилфталата в пробе.
127 Для определения формальдегида в препарате пестицида, поместили 2,7 г жидкой пробы в колбу, содержащую 50,0 см3 0,9960 M NaOH и 50,0 см3 перекиси водорода. После протекания реакции
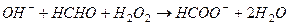
избыток щелочи оттитровали 23,30 см3 1,010 М (1/2 H2SO4). Рассчитать % содержание муравьиной кислоты в пробе.
128 1,210 г продажного KOH, имеющего примесь K2CO3, растворили в воде и разбавили до 500,0 см3. 50,00 см3 этого раствора обработали 40,00 см3 0,0530 М HCl и прокипятили до удаления CO2. На титрование избытка кислоты израсходовали 4,74 см3 0,0498 М NaOH. Вычислить % содержание KOH в техническом образце.
129 Пробу массой 14,35 г, содержащую (NH4)2SO4, и неактивные компоненты, растворили и разбавили до 200,0 см3 в мерной колбе. К 50,00 см3 раствора прибавили щелочь и выделившийся NH3 отогнали в 30 см3 0,0842 М HCl. На титрование избытка HCl израсходовано 10,0 см3 0,0880 М NaOH. Рассчитать массовую долю (%) (NH4)2SO4 в пробе.
130 Для определения Mg2+ его осадили в виде MgNH4PO4 осадок растворили в 50,00 см3 HCl. Избыток кислоты оттитрован 15,5 см3 0,1010 М NaOH. Какова масса Mg2+, если на титрование 20,00 см3 HCl расходуется 18,10 см3 щелочи.
131 Навеску 1,53 г содержащую CaCO3 и инертные примеси, растворили в 120 см3 0,2 М HCl и довели объем до 250,0 см3. Отобрали 50,00 см3 этого раствора и оттитровали избыток кислоты 13,70 см3 0,0250 М KOH. Определить массовую долю % CaCO3 в образце.
132 Для определения содержания BaCl2 в образце массой 1,1234 г, барий осадили в виде BaSO4, для чего добавили 25,00 см3 0,2000 М (1/2 H2SO4). Избыток кислоты оттитровали. Было затрачено 3,25 см3 0,0500 М HCl. Определить массовую долю % бария в образце.
133 Для определения NH3 в солях аммония 0,3200 г образца, содержащего NH4Cl и инертные примеси растворили в воде и к этому раствору добавили 40,00 см3 0,09975 М NaOH. Избыток щелочи оттитровали 0,1015 М HCl. Было затрачено 7,5 см3 HCl. Определить массовую долю (%) аммиака в образце.
134 Сколько грамм известняка, содержащего 12 % инертных примесей, было взято для анализа, если после обработки навески 50,00 см3 0,2000 М HCl на титрование избытка кислоты расходуется 8,00 см3 NaOH. Известно, что 25,00 см3 HCl реагируют с 24,10 см3 NaOH.
135 0,8881 г органического вещества обработали концентрированной H2SO4 и перевели азот в сульфат аммония, при кипячении которого с концентрированным NaOH был получен аммиак. Выделившийся NH3 был поглощен 50,00 см3 0,1200 М HCl. Сколько % азота содержит органическое вещество, если на титрование избытка HCl израсходовано 12,00 см3 0,0980 М KOH?
136 К анализируемому раствору хлорида аммония прибавили 25,00 см3 раствора NaOH с Т(NaOH) = 0,004500 г/см3. Затем кипячением удалили из раствора аммиак, а избыток NaOH оттитровали 10,50 см3 раствора HCl с Т(HCl) = 0,00375 г/см3. Вычислить массу аммиака в анализируемом растворе.
137 Навеску азотной кислоты 1,0100 г перевели в раствор, содержащий 25,00 см3 0,5020 М NaOH. Оставшийся после реакции избыток NaOH оттитровали 10,50 см3 0,1010 М HCl. Вычислить массовую долю HNO3 в кислоте.
138 Пробу соли аммония 1,000 г обработали избытком концентрированного NaOH. Выделившийся аммиак был поглощен 50,00 см3 1,0510 М HCl. Избыток кислоты оттитровали 25,0 см3 раствора NaOH; ТNaOH = 0,042000 г/см3. Вычислить массовую долю аммиака в пробе соли.
139 К навеске химически чистого Na3PO4 0,1000 г прибавили 50,00 см3 0,2000 М (1/2 H2SO4). На обратное титрование избытка кислоты с метиловым оранжевым израсходовали 15,00 см3 NaOH. Определить молярную концентрацию раствора щелочи.
140 Образец сплава, массой 1,500 г растворили в концентрированной HCl. Цинк, содержащийся в сплаве, осадили в виде ZnNH4PO4. Осадок промыли и растворили в 50,00 см3 KOH, имеющей  = 0,001120 г/ см3. Сколько % цинка в сплаве, если на титрование избытка щелочи израсходовано 16,50 см3 HNO3. 10,00 см3 HNO3 реагируют с 10,35 см3 раствора KOH.
= 0,001120 г/ см3. Сколько % цинка в сплаве, если на титрование избытка щелочи израсходовано 16,50 см3 HNO3. 10,00 см3 HNO3 реагируют с 10,35 см3 раствора KOH.
141. Для анализа взято 0,1254 г бихромата калия и растворено. Выделенный из иодида калия йод, оттитрован 24,85 см3 0,09978 (Na2S2O3·5H2O) вычислить массовую долю (%) оксида хрома (6) в образце.
142. К 10,00 см3 сероводородной воды прибавлено 50,00 см3 раствора йода, на титрование избытка которого потребовалось для титрования 32,79 см3 раствора тиосульфата натрия. Вычислить % сероводорода в воде, если поправочный коэффициент К = 1,1120 к 0,1 М (1/2 I2), а К = 0,9730 к 0,1 M. (Na2S2O3·5 H2O).
143. Сколько процентов нитрита натрия содержит технический образец, если после растворения 1,3074 г этого образца в 500,0 см3 на титрование 25,00 см3 0,09815 (1/5 KMnO4) 35,11 см3 этого раствора.
144. Сколько процентов FeC2O4 содержит образец, если навеска его равна 0,2596 г и на окисление его затрачивается 44,77 см3 раствора KMnO4, для которого K = 1,156; С (1/5 KMnO4) = 0,1 моль/ см3.
145. Сколько процентов сурьмы содержит сплав, если навеска его 1,000 г после растворения оттитрована 42,50 см3 раствора KMnO4 c  = 0,006124 г/ дм3
= 0,006124 г/ дм3
146. Сколько процентов Fe2O3 содержит образец, если его навеска 0,1700 г после растворения и восстановления железа оттитрована 38,4 см3 раствора KMnO4 c  = 0,0001100 г/ см3.
= 0,0001100 г/ см3.
147. Для определения массовой доли изопропанола в техническом продукте навеску его 1,5000 г обработали 50,00 см3 1,000 М (1/6 K2Cr2O7) в растворе H2SO4 в течении 30 минут. Затем объем раствора довели до 500,0 см3, отобрали 25,00 см3 и определили в нем иодометрически избыток K2Cr2O7: прибавили KI, выдержали 10 мин, выделившийся йод оттитровали 0,1000 М Na2S2O3 в присутствии крахмала. На титрование израсходовано 12,45 см3 Na2S2O3. При взаимодействии изопропанола с K2Cr2O7 спирт окисляется до ацетона по реакции:
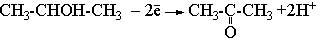
Определить массовую долю изопропанола.
148. Для определения примеси этанола в эфире его отогнали из навески эфира 3,5000 г. Полученный дистиллят обработали 10,00 см3 0,2000 М (1/6 K2Cr2O7) в сернокислой среде при нагревании. После охлаждения и разбавления водой к раствору добавили 5 мл 10 %-ного раствора KI, выделившийся йод оттитровали 0,1 М Na2S2O3, на титрование затрачено 14,85 см3. Определить массовую долю этанола. При взаимодействии этанола с K2Cr2O7 он окисляется до уксусной кислоты.
149. Навеска 1,150 г H2O2 разбавлена в мерной колбе на 250 см3. На титрование 25,00 см3 этого раствора расходуется 30,25 см3 раствора перманганата калия  = 0,0004542 г/ см3. Сколько % активного кислорода содержит образец перекиси?
= 0,0004542 г/ см3. Сколько % активного кислорода содержит образец перекиси?
150. Навеска 0,0921 г хромотропового ангидрида растворена, обработана KI и HCl и оттитрована 23,75 см3 раствора тиосульфата  = 0,01354. Сколько % CrO3 содержал образец?
= 0,01354. Сколько % CrO3 содержал образец?
151. Сколько Na2S содержится в исследуемом образце, если была взята навеска 0,9282 г образца и растворена в 250 см3. К 25 см3 полученного раствора добавили 40 см3 0,1011 М (1/2 I2), избыток которого был оттитрован 24,4 см3 0,1038 М (Na2S2O3).
152. 1,2116 г. Белильной извести растворено в колбе на 250 см3 и обработано KI в кислой среде. На титрование выделившегося йода из 25,00 см3 раствора извести израсходовано 23,50 см3 0,1036 М (Na2S2O3) Определить % хлора в белильной извести.
153. Навеску сплава меди массой 2,536 г. растворили в азотной кислоте. Раствор довели до метки в мерной колбе 200,0 см3, отобрала 15,00 см3 этого раствора, добавили избыток KI, а выделившийся оттитровали 0,049 М (Na2S2O3·5H2O) концентрация которого определялось отдельно. На титрование пошло 8,7 см3 тиосульфата натрия. Определить массовую долю меди в сплаве.
154. Для анализа стали на содержание марганца, растворили 0,3510 г. образца. Марганец окислен до HMnO4, на титрование которой израсходовано 8,43 см3 К = 1,004 к 0,03 (1/2 Na3AsO3). Сколько % марганца содержал образец стали.
155. Для определения концентрации раствора арсенита натрия взяли 0,1182 г стандартного образца стали, с массовой долей марганца 0,84%. После соответствующей обработки, в результате которой Mn2+ превратился в MnO–4. На титрование полученной HMnO4, израсходовали 22,27 см3 раствора арсенита натрия. Чему равен титр арсенита натрия по марганцу.
156. Для определения содержания олова в сплавах его превращают в SnSO4, который титруют рабочим раствором йода без доступа воздуха. Определить содержание олова в бронзе, если навеска бронзы 0,9122 г объем раствора йода, пошедшего на титрование – 15,73 см3; 0,03523 М (1/2 I2).
157. Найти массовую долю сульфита натрия Na2SO3 в образце, если 0,7346 г его было растворено в колбе на 100,0 см3. Полученным раствором титруется 20,00 см3 0,0544 М (1/2 I2), при этом расходуется 23,15 см3 анализируемого раствора.
158. К 25 см3 раствора H2O2 прибавили 50,00 см3 0,01960 М (1/2 I2). Избыток йода, не вступивший в реакцию, оттитровали 0,02040 М (Na2S2O3), которого пошло 11,00 см3. Сколько перекиси водорода содержал 1 дм3 исходного раствора.
159. Для определения свинца навеска руды 5,000 г была растворена в кислоте, свинец был осажден в виде PbCrO4, осадок отфильтрован, промыт и растворен в смеси HCl и KI. Выделившийся при этой реакции йод оттитровали 0,5000 М (Na2S2O3·5H2O), было израсходовано 42,00 см3 титранта. Сколько % свинца в руде?
160. Определить массу салицилата натрия (C7H5O3Na), если его растворили в мерной колбе на 100,0 см3, отобрали пипеткой 20,00 см3, прибавили 25,00 см3 смеси 0,1 М (1/6 KBrO3), 1 г KBr и 4М HCl. После перемешивания дают постоять, вносят 1 г KI и 2-3 см3 хлороформа. Выделившийся йод оттитровали 0,1000 М (Na2S2O3), которого пошло на титрование 20,53 см3.
161. Концентрация рабочего раствора ЭДТА была установлена по раствору, содержащему в 1,00 дм3 25,00 г железоаммонийных квасцов. На титрование 10,00 см3 этого раствора израсходовано 12,50 см3 ЭДТА. Рассчитать молярную концентрацию раствора ЭДТА.
162. Рассчитать концентрацию магния в воде (в ммоль/дм3), если при титровании 200,0 см3 воды ЭДТА при рН = 9,7 с хромогеном черным Т до синей окраски израсходовано 25,15 см3 0,01512 М раствора.
163. Исследуемый раствор хлорида никеля разбавлен до 250,0 см3. К 25,00 см3 этого раствора добавлено 15,00 см3 0,0150 М ЭДТА, избыток которого оттитровали 5,60 см3 0,015 М MgSO4. Рассчитать массу никеля в исследуемом растворе.
164. Молибдат-ион осадили в виде CaMoO4. В осадке оттитровали кальций 12,50 см3 0,0450 М ЭДТА. Рассчитать массу MoO42- в растворе.
165. На титрование при рН = 2 раствора нитрата тория в присутствии пирокатехинового фиолетового израсходовано 15,20 см3 0,025 М ЭДТА. Рассчитать массу тория в растворе.
166. Раствор ЭДТА приготовили растворением 10,00 г чистой этилендиаминтетрауксусной кислоты в небольшом объеме едкого натра и разбавленном точно до 500,0 см3 рассчитать для этого раствора: молярную концентрацию; титр по кальцию, в мг/см3; титр по карбонату магния, в мг/см3.
167. 3,85 г очищенного Na2H2Y·2H2O растворили в колбе на 500,0 см3. Рассчитайте молярную концентрацию и титр по Ca2+ этого раствора. Сколько этого раствора пойдет на титрование 50 мл воды, имеющей общую жесткость 3,2 ммоль/дм3
168. Рассчитать массу алюминия в растворе по следующим данным: к раствору добавили 25,00 см3 0,040 М ЭДТА, избыток которого был оттитрован 5,00 см3 0,0350 М раствора сульфата цинка.
169. Навеску нитрата ртути (2), равную 0,6865 г растворили в 250,0 см3 воды. На титрование 25,00 см3 этого раствора в присутствии индикатора эриохрома черного Т израсходовано 8,50 см3 0,0220 М раствора ЭДТА. Рассчитать массовую долю нитрата ртути в исследуемом образце соли.
170. Определить содержание NaF (в г/дм3) в электролите, если к 10,00 см3 электролита добавлено 20,00 см3 0,0500 М раствора CaCl2, избыток которого оттитрован 2,50 см3 раствора комплексона III, с титром по фториду натрия 0,0042 г/см3.
171. 50,00 см3 минеральной воды, содержащей CaCO3 и Mg CO3, оттитровали 0,0457 М (1/2 ЭДТА). В присутствии хромогена черного было затрачено 7,50 см3 комплексона, а в присутствии мурексида – 3,20 см3. Определить общую жесткость воды (в ммоль/дм3), а также содержание (в г/дм3) солей в этой воде.
172. На титрование 50 см3 раствора, содержащего Fe2+, Fe3+, потребовалось 13,70 см3 0,0120 М ЭДТА при рН = 2 и 29,60 мл при рН = 6. Выразить концентрацию каждого из растворенных веществ в мг/ см3.
173. Титр раствора ЭДТА по MgO равен 2,34×10-3 мг/см3. Рассчитайте молярность этого раствора, нормальность и титр по Fe2O3. Сколько этого раствора пойдет на титрование 25,00 мл воды, имеющий общую жесткость 4,85 ммоль/дм3.
174. Определить жесткость воды, если к 50,00 см3 воды добавлено 25,00 см3 0,0500 М комплексона III. Избыток комплексона оттитрован 20,50 см3 0,0500 М MgSO4
175. Определить нормальность раствора серной кислоты, если к 10 см3 раствора ее добавлен избыток 0,2000 М (1/2 BaCl2), осадок отфильтрован, промыт. К осадку добавлено 50,00 см3 0,0500 М (1/2 комплексон III), избыток последнего оттитрован 20,50 см3 0,0450 М раствора MgSO4.
176. Определить массовую долю Na2CO3 в образце с массой 0,2458 г После растворения навески к раствору добавлено 20,00 см3 0,0450 М MgSO4, избыток которого оттитрована 15,00 см3 комплексона III. (1 см3 MgSO4 эквивалентен 1,25 см3 комплексона III).
177. Определить содержание Na2SO4·H2O (в г/дм3) в электролите, если к 10,00 см3 этого раствора добавлено 50,00 см3 0,1 М (1/2 Pb(NO3)2), избыток нитрата свинца оттитрован 10,00 см3 0,0900 н. раствора комплексона III.
178. Определить массовую содержание пирофосфата натрия, если после растворения навески 0,1000 г. добавлено 25,00 см3 0,1105 М (1/2 ZnSO4). Раствор нейтрализован, осадок отфильтрован, избыток сульфата цинка оттитрован 10,00 см3 0,09875 М раствора комплексона III.
179. Определите массовую долю (NH4)2C2O4·H2O, если после растворения навески 0,2224 г к раствору добавлено 25,00 мл 0,1112 М(1/2 CaCl2), избыток соли Ca2+ оттитрован 18,50 см3 комплексона с титром по кальцию 0,002004 г/см3
180. К 10,00 см3 раствора, содержащего пиридин, добавили спиртовой раствор CdCl2. Выпавший осадок Cd(C5H5N)2Cl2 отфильтровали, растворили и оттитровали 15,25 см3 0,0100 М ЭДТА с эриохромом черным Т в аммиачном буферном растворе. Рассчитайте концентрацию (г/дм3) пиридина в исходном растворе. Молекулярная масса пиридина 79,00 г/моль.
181. Раствор NH4CNS стандартизировался по раствору AgNO3, который был получен растворением 0,1030 г х.ч. AgNO3 в произвольном объеме. На титрование израсходовано 27,50 см3 раствора роданида аммония. Рассчитать сколько роданида аммония содержится в 500 см3 раствора.
182. Рассчитайте массовые доли (%) NaCl и КCl в образце, если после растворения навески массой 0,1526 г на титрование полученного раствора израсходовано 25,00 см3 0,1000 М раствора нитрата серебра.
183. Рассчитайте массовую долю (%) KBr в образце. Навеску технического бромида калия массой 1,255 г растворили в мерной колбе вместимостью 250,0 см3; к 15,00 см3 этого раствора добавили 25,00 см3 0,0500 н. раствора нитрата ртути (1). Избыток нитрата ртути (1) оттитровали 0,0500 М раствором хлорида натрия, израсходовав 15,00 см3
184. Рассчитайте массовую долю (%) брома в соединении. Навеску образца массой 0,7589 г обработали этанольным раствором KOH и провели омыление, раствор подкислили и разбавили до 250,0 см3. полученный раствор объемом 10,00 см3 оттитровали 6,80 см3 0,0550 М Hg2(NO3)2. На титрование индикатора Fe(SCN)n(3-n) в контрольном опыте затрачено 0,55 см3 Hg2(NO3)2.
185. Какое вещества NaCl или KCl было взято для анализа, если на титрование 0,2542 г его было израсходовано 30,86 см3 0,1105 М AgNO3.
186. Рассчитайте массу навески хлорида бария, содержащуюся в 200 см3 этого раствора, если после прибавления к 20,00 см3 его 35,00 см3 0,1105 М AgNO3. на обратное титрование избытка нитрата серебра израсходовано 20,50 см3 0,1015 М раствора роданида аммония.
187. Рассчитайте массу навески сплава, содержащего 40% серебра, если после растворения сплава добавили 25,25 см3 0,1575 М NH4SCN и избыток его оттитровали 20,00 см3 0,1000 М AgNO3.
188. Сколько грамм кальция содержится в 250 см3 раствора CaCl2, если после добавления к 25 см3 этого раствора 40 см3 0,1000 М (1/2(NH4)2C2O4) и отделения образовавшегося осадка CaC2O4 на титрование не вошедшего в реакцию (NH4)2C2O4 израсходовано 15,00 см3 0,02000 M. (1/5 KMnO4)?
189. Сколько см3 0,2500 М (NH4)2C2O4 требуется для осаждения кальция из раствора, полученного при растворении 0,7000 г мела, который содержит 6% примесей.
190. Для осаждения серебра из 100,0 см3 раствора, содержащего 0,3398 г AgNO3, израсходовано 17,00 см3 0,1000 М HCl. Вычислить количество серебра, оставшегося не осажденным и ошибку при анализе (%).
191. Фторид-ион, содержащийся в пробе пестицида массой 0,5100 г после соответствующей обработки пробы осадили в виде PbClF. Осадок растворили в 5 % азотной кислоте и осадили хлорид-ион добавлением 50,00 см3 0,2000 М AgNO3. Осадок AgCl покрыли слоем нитробензола и избыток Ag+ оттитровали, затратив 7,42 см3 0,1760 М NH4CNS. Рассчитать % содержание фторид - иона в пробе.
192. Для определения фторид-иона в салате 50,00 г его высушили и прокалили с CaO. Образовавшийся CaF2 разложили кислотой в присутствии SiO2 и полученный газ SiF4 отогнали на титрование F- по реакции:
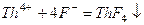 ,
,
затратив 7,62 см3 0,00893 М (1/4 Th(NO3)4). Сколько % фторида в пробе?
193. После растворения и соответствующей обработки 0,9860 г удобрения получили водный раствор, содержащий HPO42-, который количественно осадили добавлением 40,00 см3 0,2040 М AgNO3. На титрование избытка серебра после отделения осадка потребовалось 8,72 см3 0,1170 М KCNS. Рассчитать % P2O5 в пробе.
194. 7,5 г. пробы, содержащей смесь йодида и хлорида бария и инертные примеси растворили и разбавили до 250,0 см3, отобрали 50,00 см3 раствора и оттитровали раствором 0,08470 М AgNO3 с индикатором эозином, который адсорбируется только после осаждения иодид-иона. На титрование израсходовали 38,30 см3 нитрата серебра. Вторую аликвоту, объемом 25,00 см3, оттитровали с бромфеноловым синим, который меняет окраску, после осаждения ионов хлора и йода. На титрование пошло 41,20 см3 AgNO3. Сколько % BaCl2 и BaI2 в исходной пробе.
195. К раствору, полученному при обработке кислотой 0,2130 г сплава, содержащему цинк, добавили 40,00 см3 0,09320 М (1/3 K4[Fe(CN)6]). Осадок K2Zn3[Fe(CN)6]3, раствор, содержащий избыток K4[Fe(CN)6] оттитровали, затратив 4,44 см3 0,1060 М (1/2 Zn2+) в присутствии дифениламина в качестве индикатора. Сколько % Zn в сплаве?
196. Для достижения конечной точки титрования по методу Мора 0,2240 г пробы, содержащей только BaCl2 и KBr, потребовалось 19,70 см3 0,1000 М AgNO3. Рассчитать % содержание каждого компонента в пробе.
197. Раствор Na2S стандартизирован титрованием раствора реагента, приготовленного растворением 0,2130 г чистого цинка в кислоте с последующей нейтрализацией. На титрование Zn2+ пошло 36,30 см3 раствора сульфида натрия. Рассчитать С(fэкв.Na2S) и  .
.
198. Для определения йода в водорослях из навески 0,5750 г после соответствующей обработки пробы осадили йод в виде PbI2. Осадок растворили и осадили иодид-ион добавлением 25,00 см3 0,2000 М Hg2(NO3)2, избыток Hg22+ оттитровали, затратив 3,7 см3 0,1250 М NH4CNS. Рассчитать % I– в пробе.
199. Формальдегид из 5,00 г протравы для семян отогнали с водяным паром, и собрали в колбу емкостью 500,0 см3. Аликвоту 25,00 см3 обработали 30,00 см3 0,121 М KCN для превращения CH2O в циангидрин калия:

избыток KCN удалили добавлением 40,00 см3 0,1000 М AgNO3 на титрование избытка Ag+ в фильтрате потребовалось 16,10 см3 0,1340 М NH4CNS. Рассчитать % CH2O в пробе.
200. Для определения Ca2+ 0,5864 г образца растворили и осадили кальций в виде CaF2 добавлением 20,00 см3 0,4000 М HF. Избыток F- был оттитрована раствором 0,0500 М Al2(SO4)3. На титрование избытка фторид-иона израсходовано 12,70 см3 сульфата алюминия. Определить % Ca в образце.
Дата публикования: 2015-07-22; Прочитано: 2304 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
