 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Рассчитать титры следующих растворов
|
|
| № | Вещество | Сf экв, моль/л | № | Вещество | Сf экв, моль/л |
| HCl | 0,01 | KMnO4 | 0,05 | ||
| NH4OH | 0,1 | H2C2O4 | 0,036 | ||
| BaCl2 | 0,05 | Na2SO3 | 0,152 | ||
| H2SO4 | 0,01 | CuSO4 | 0,0435 | ||
| KOH | 0,3 | FeCl3 | 0,0157 | ||
| AlCl3 | 0,02 | H3AsO4 | 0,0386 | ||
| Fe2(SO4)3 | 0,05 | Ba(OH)2 | 0,235 | ||
| K2Cr2O7 | 0,03 | KI | 0,0427 | ||
| Na2S2O3 | 0,025 | Hg(NO3)2 | 0,0385 | ||
| SnCl2 | 1,06 | Cr2(SO4)3 | 0,123 |
Рассчитать титр по определяемому веществу (ТA/B)
| № | A | Т, г/см3 | B | № | A | Т, г/см3 | B |
| AgNO3 | 0,011 | Br - | KMnO4 | 0,0387 | Na2SO3 | ||
| H2SO4 | 0,0236 | NaOH | KMnO4 | 0,0425 | FeO | ||
| H2SO4 | 0,0236 | KOH | K2Cr2O7 | 0,00918 | I2 | ||
| H2SO4 | 0,0193 | CaO | K2Cr2O7 | 0,0157 | Na2SO3 | ||
| HCl | 0,00427 | NaOH | Na3AsO4 | 0,0391 | I2 | ||
| HCl | 0,00615 | Ba(OH)2 | Na3AsO4 | 0,0423 | Fe | ||
| HNO3 | 0,0138 | LiOH | H3AsO4 | 0,00925 | KI | ||
| HNO3 | 0,0245 | CuO | H3AsO4 | 0,0867 | S | ||
| H2SO4 | 0,0519 | Na2CO3 | KClO3 | 0,0136 | KBr | ||
| HBr | 0,0374 | Hg | KClO3 | 0,00945 | Na2S |
101 Навеску Na2CO3 0,5300 г растворили в мерной колбе вместимостью 250,0 см3. 25,00 см3 этого раствора оттитровали 24,50 см3 HCl в присутствии метилового оранжевого. Вычислить молярную концентрацию эквивалента раствора карбоната натрия и молярную концентрацию раствора HCl.
102 На титрование 20,00 см3 раствора Ba(OH)2 израсходовали 15,00 см3 0,2 М HCl. Вычислить молярную концентрацию эквивалента и титр Ba(OH)2.
103 Вычислить молярную концентрацию эквивалента и титр H2SO4, если на титрование 50,00 см3 раствора Na2CO3, полученного растворением навески его 0,5000 г в мерной колбе на 200 см3, расходуется 24,00 см3 H2SO4.
104 Навеска уксусной кислоты 1,000 г растворили в мерной колбе вместимостью 200,0 см3. На титрование 20,00 см3 этого раствора израсходовали 15,50 см3 NaOH, Т(NaOH) = 0,004088 г/см3. Вычислить массовую долю (%) CH3COOH в образце.
105 Какой объем 0,09950 М раствора NaOH потребуется для нейтрализации примеси муравьиной кислоты в формалине, навеска которого равна 10,00 г? Массовая доля кислоты составляет 0,04 %.
106 Для определения содержания основного продукта в калиевой соли α – нафтилуксусной кислоты навеску 0,7524 г растворили в мерной колбе вместимостью 500,0 см3. К 100,0 мл полученного раствора прибавили 10 % - ную серную кислоту и выделившуюся свободную α – нафтилуксусную кислоту трижды проэкстрагировали бензолом. Вытяжки собрали вместе, бензол отогнали, кислоту растворили в воде и оттитровали 12,63 см3 0,01200 М КОН в присутствии фенолфталеина. Определить массовую долю кислоты. М (С11Н9СООК) = 224,3 г/моль.
107 На титрование 0,2290 г чистой органической кислоты до перехода окраски фенолфталеина потребовалось 29,80 см3 0,1 М NaOH. Какова эквивалентная масса кислоты?
108 Навеску азотной кислоты 0,5050 г перевели в раствор, затем оттитровали 5,05 см3 0,2080 М NaOH. Вычислить массовую долю N2O5 в навеске кислоты.
109 25,00 см3 моющего раствора разбавили в колбе до 250,0 см3. На титрование 50,00 см3 этого раствора до перехода окраски бромкрезолового зеленого пошло 40,00 см3 0,2500 M HCl. Рассчитать содержание аммиака в %, если щелочность образца определяется только этим компонентом.
110 Раствор HСlO4 стандартизировали по раствору содержащему 0,3741 г оксида ртути HgO в растворе бромида калия KBr:

на титрование OH- потребовалось 37,70 см3 хлорной кислоты. Рассчитать молярную концентрацию эквивалента хлорной кислоты.
111 Навеску серусодержащего органического соединения массой 0,1210 г сожгли в токе О2. Выделившийся SO2 поглотили раствором Н2О2
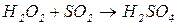
На титрование образовавшейся кислоты израсходовано 20,50 см3 0,107 М KOH. Рассчитать % серы в образце.
112 Сколько грамм KOH и K2CO3 содержит препарат едкого кали, если на титрование его раствора в произвольном объеме воды с фенолфталеином пошло 22,40 см3 соляной кислоты, а с метилоранжем 25,80 см3 0,0950 M HCl.
113 Какую навеску янтарной кислоты H2C4H4O4 следует взять для установки титра 0,1516 M KOH, если кислоту растворить в колбе 250,0 см3.
114 Определить молярную концентрацию эквивалента и титр раствора NaOH, если на титрование 0,1495 г янтарной кислоты, растворенной в произвольном объеме расходуется 25,20 см3 щелочи.
115 Для установки титра H2SO4 была взята навеска буры равная 0,4718 г. На титрование этого количества буры, растворенной в произвольном объеме, затрачено 18,75 см3 H2SO4. Вычислить  и
и 
116 Для приготовления 250,0 см3 раствора бифталата калия С6H4СООНCOOК взята навеска массой 5,000 г. Определить молярную концентрацию эквивалента и титр раствора КОН, если на титрование 20,00 см3 щелочи расходуется 19,55 см3 раствора бифталата калия.
117 Определить  и массу кислоты в данном растворе, если при титровании данного раствора израсходовано 21,3 см3 0,2057 М NaOH.
и массу кислоты в данном растворе, если при титровании данного раствора израсходовано 21,3 см3 0,2057 М NaOH.
118 При титровании 25,00 см3 раствора, содержащего смесь NaHCO3 и Na2CO3, с фенолфталеином израсходовано 9,46 см3, а с метилоранжем – 24,85 см3 0,1010 М HCl. Сколько NaHCO3 и Na2CO3 содержится в 200 см3 раствора?
119 Сколько грамм KOH и K2CO3 содержит навеска препарата технического едкого кали, если на титрование ее раствора в произвольном количестве воды расходуется 22,40 см3 при использовании фенолфталеина в качестве индикатора и 25,80 см3 0,0950 M. HCl при использовании метилоранжа?
120 Определить массовую долю примесей в образце технической азотной кислоты, если на титрование 1,00 г ее идет 25,00 см3 KOH с ТКОН= 0,01120 г/см3
Дата публикования: 2015-07-22; Прочитано: 1571 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
