 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Краткая теория. Электролиз – это совокупность процессов, происходящих при прохождении постоянного электрического тока через электрохимическую систему
|
|
Вопросами электролиза занимаются один из разделов курса " Физическая химия", который получил название " Электрохимия "
Электролиз – это совокупность процессов, происходящих при прохождении постоянного электрического тока через электрохимическую систему, состоящую из двух электродов - катода и анода, и расплава или раствора электролита.
В любом растворе имеются положительно и отрицательно заряженные ионы – катионы (+) и анионы (-). Если в такое раствор поместить два электрода, то катионы станут перемещаться к катоду, а анионы к аноду. Например: при электролизе ZnCI2
К(-): Zn2+ -2ē ÞZn° (1.1)
А(+): 2Сl- - 2ēÞСl° (1.2)
При электролизе химическая реакции происходит за счет тока подводимого извне и за счет этого протекания через электролит. Путем электролиза можно получить ряд чистых металлов (Zn, Сu, Fе и т.д.) Электролит – это один из наиболее эффективных методов защиты от коррозии металлов.
Коррозия – это самопроизвольный процесс разрушения металлов за счет взаимодействия его с окружающей средой.
Основные виды коррозии – электрохимическая и химическая.
Широко применяемый метод борьбы с коррозией – это нанесение гальванических покрытий, который осуществляется электролизом водных раствором солей, с растворим анодом.
Металлические покрытия, в зависимости от механизма защитного действия, разделяют на анодные и катодные. В качестве анодных покрытий используют металлы с более электроотрицательным электродным потенциалом, чем потенциал защищаемого металла, а в катодных с более положительным значением потенциала. Так для Fе анодным покрытием может служить Zn, т.е. будут проходить такие реакции:
A (+): Zn0-2ē=Zn2+ (1.3)
К(-): 2Н++2ē=Н20 (1.4)
В кислой среде Fe является катодом и служит лишь переносчиком электронов, на нем происходит выделение водорода. Для того, чтобы определять какое покрытие в среде электролита будет катодным, а какое анодным, необходимо знать ряд напряжений металлов и свойства этого ряда.
Li, К, Ва, Са, Na, Mg, Al, Мn, Zn, Fe, Co, Ni, Sn, Pb, [H], Bi, Cu, Hg, Ag, Au.
Свойства ряда напряжений металлов:
1. Чем левее в ряду напряжений стоит металл, тем он активнее.
2. Каждый металл вытесняет все последующие за ним металлы из растворов их солей (справедливо после Mg).
3. Металлы, которые расположены в ряду напряжений до водорода, вытесняют его из кислот неокислителей.
4. Металлы, которые стоят в ряду напряжений после водорода [ H2], не растворяются в кислотах -неокислителях, потому что не могут вытеснить водород.
Этот ряд справедлив только для водных растворов. Катодными покрытиями для Fе могут быть Cu, Ni, Sn. В этом случае при нарушении покрытий происходит разрушение основного металла. При определении выхода металла по току руководствуются двумя законами, устанавливающими соотношение между количеством полученных на электродах продуктов и количеством протекшего через электролит электрического тока. Основным законом электролиза является закон Фарадея (1.5), согласно которому количество вещества, претерпевшего превращение на электроде, пропорционально количеству протекшего электричества и эквивалентной массе данного вещества:
M = 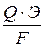 , (1.5)
, (1.5)
где M – количество выделившеюся вещества на электроде, г;
Q – количество электричества, протекшего по электроду, A · с;
Q= I · t
F – число Фарадея; F =96496 Кл;
Поскольку Q = 1А· 1 с = 1 Кл, a Q = 1А · 1 ч.= 3600 Кл, то F =96493/3600=26.8 A· ч
Тогда формула (1.5) может быть представлена так:
М =  , (1.6)
, (1.6)
где Э – эквивалентная масса металла, равная отношению атомарного веса металла к валентности, г.
Э=А/n
Практически металл выделяется на электроде меньше, чем по формуле (1.6), так как на осаждение металла расходуется лишь часть протекшего электричества, остальная его часть расходуется на побочные электрохимические процессы (например выделение Н2)
Выраженное в процентах отношение весового количества металла, выделившегося на электроде, к его теоретически возможному весовому количеству m, в соответствии с законом Фарадея, называется методным или анодным выходом металла по току h:
h=mp/m ·100% (1.7)
Заменив в уравнении (1.6) m через отношение, выраженное уравнением (1.7) получим:
h=mp ·26.8 /(I·t·Э)· 100% (1.8)
Дата публикования: 2015-07-22; Прочитано: 216 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
