 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Зависимость константы равновесия от температуры
|
|
УРАВНЕНИЕ ИЗОТЕРМЫ РЕАКЦИИ
При изучении химической реакции важно знать, будет ли она протекать, а если будет, то в каком направлении.На это можно ответить, применяя к химическим реакциям второй закон термодинамики, согласно которому всякий самопроизвольный процесс, в том числе и химическая реакция в изолированной системе, протекает в направлении увеличения энтропии. При р и T=const реакция протекает самопроизвольно в направлении уменьшения энергии Гиббса. Если все реагирующие вещества подчиняются законам идеальных газов, то ее уменьшение, наблюдаемое при обратном протекании реакции до состояния равновесия, выражается уравнением
- ∆G= RTlnKp – RTln [ Pb¢1n¢1Pb¢2n¢2 / (Pb1n1Pb2n2 ) (4)
где Pb¢1, Pb¢2 … и Pb1, Pb2 … произвольные парциальные давления исходных
и конечных веществ. Для реальных систем в уравнение (4) вместо парциальных давлений следует подставлять фугитивности или активности. Уравнение (4) позволяет установить влияние температуры, давления инертного газа и начальных концентраций реагентов на направленность химической реакции.
В стандартном состоянии при всех парциальных давлениях, равных 1 атм,
- ∆GºТ = RTlnKp (5)
ЗАВИСИМОСТЬ КОНСТАНТЫ РАВНОВЕСИЯ ОТ ТЕМПЕРАТУРЫ
Зависимость константы равновесия от температуры описывается уравнением Вант-Гоффа
d ln Кp/ d T = D H0/ RT2
Это уравнение выведено из уравнения Гиббса—Гельмгольца
DG0=DH0+T(dDG0 / dT)p(7)
и уравнения
— D GT0= RT ln Kp (8)
где D Н0— изменение энтальпии (тепловой эффект) реакции. Знак теплового эффекта определяет знак производной dln Kр /dT в уравнении изобары Вант-Гоффа (6). Если D НT0 >0 (эндотермическая реакция), знак производной положителен, следовательно, константа равновесия с повышением температуры возрастает (рис.1). Если D НT0 <0 (экзотермическая реакция), то константа равновесия с повышением температуры уменьшается. Если D НT0 ~ 0 (тепловой эффект весьма мал), то константа равновесия не зависит от температуры. Согласно закону Гесса для уравнения реакции
n1B1+n2B2 = n1¢B1¢ +n2¢B2¢
DН0 = n1¢DН0f, B1¢ + n2¢DН0f, B2¢ — n1DН0f, B1 —n2DН0f, B2, (9)
где D Н0f, B1¢,D Н0f, B2¢... — теплотыобразования одного молясоответствующего вещества.
Теплоты образования должны быть взяты при тех же условиях,
при которых определялся тепловой эффект реакции. Если теплоты образования взяты при стандартных условиях, то и тепловой эффект реакции получается при этих же условиях. Затем тепловой эффект при базисной температуре пересчитывается по уравнению Кирхгофа на ту температуру, при которой рассчитывается энергия Гиббса реакции
(d D H0 / dT)p= D с0p, откуда
D HT0= D H2980+ 298òTD с0p(T)dT (10)
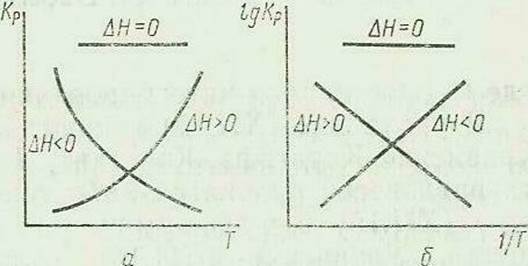
|
рис. 1. Зависимость константы равновесия реакции от температуры (а) и логарифма константы равновесия реакцииотобратной температуры (б)
Чтобы вычислить константу равновесия при любой температуре, следует проинтегрировать уравнение Вант-Гоффа.
1. При допущении независимости теплового эффекта от температуры интегрирование уравнения (XII.6) дает приближенное выражение
lg Kp= - ΔHº/ 2,303 R ∙ 1/T + const; lg Kp= A/T + B, (11)
или
lg Kp, T2/ lg Kp, T1 = ΔHº/ 2,303 R ∙ (1/T1 - 1/T2). (12)
2. Для учета зависимости теплового эффекта от температуры требуется знать температурные зависимости молекулярных теплоемкостей реагентов Cр°(T). Обычно эти зависимости представляют степенными рядами поT;
Cр°= a + bT + cT2 + c′/T2.
Тогда для реакции можно написать
ΔCр°= Δa +Δ bT +Δ cT2 + Δc′/T2. (13)
гдеΔa, Δb, Δc, Δc′—алгебраические суммы, которые вычисляют по соответственным коэффициентам для теплоемкостей индивидуальных веществ. Согласно уравнению (10) получаем зависимость теплового эффекта от температуры:
ΔHºT= ΔHo + ΔaT +1/2 Δ bT2 +1/3Δ cT3 - Δc′/T. (14)
Подставляя в уравнение Вант-Гоффа значениеΔHo из уравнения (14) после интегрирования и переходя от натуральных логарифмов к десятичным, получаем
lg Kp= - ΔHº/ 2,303 RT + Δa lgT/R + Δ bT/2∙2,303R + Δ cT2/6∙2,303R –
- Δc′T-2/2∙2,303R + I, (15)
где I – постоянная интегрирования.
В уравнение (15) входит константа интегрирования ΔHº уравнения Кирхгофа. Константу I можно вычислить, если константа равновесия при какой-либо температуре определена по уравнению (15) или из химических констант индивидуальных веществ. Уравнение (15) является в отличие от уравнения (11) принципиально точным.
Для вычисления постоянной интегрированияI, а следовательно,. и константы равновесия, существует несколько методов. Одним из таких методов расчета Кр является метод, который основан на применении стандартных таблиц термодинамических функции. В качестве стандартных условий принимают давление р=1 атм и базисную температуру Т=298,15 К. Стандартные таблицы содержат абсолютные значения энтропии Sо298 для простых веществ и химических соединений, величины ΔHºf,298 или ΔGof,298 для химических соединений. Эти величины выражают изменения энтальпии и энергии Гиббса при реакции образования соединения из простых веществ. Для простыx веществ, устойчивых при стандартных условиях, ΔHºf,298 и ΔGof,298 принимают равными нулю. При помощи данных, приведенных в стандартных таблицах, вычислим ΔHº298 или ΔGo298 данного химического процесса:
DН0298 = n1¢(DН0f, 298)B1¢ +n2¢(DН0f, 298)B2¢ — n1(DН0f, 298)B1 —n2(DН0f,298) B2, (16)
DG0298 = n1¢(DG0f, 298)B1¢+n2¢(DG0f, 298)B2¢ — n1(DG0f, 298)B1 —n2(DG0f,298) B2, (17)
DS0298 = n1¢(S0f, 298)B1¢+n2¢(S0f, 298)B2¢ — n1(S0f, 298)B1 —n2(S0f,298) B2, (18)
Поскольку DG0298 = DН0298 - ТDS0298,
то DG0298 = - RTlnKp.
Отсюда вычисляем при Т==298 К
lgKp= DG0298/(2,3R∙298)
Итак, для вычисления константы равновесия реакции необходимо знать для каждого из реагирующих веществ: 1) температурную зависимость теплоемкости Ср°; 2) изменение энтальпии образования при стандартных условиях ΔHºf,298; 3) энтропию S0298 или изменение энергии Гиббса при стандартных условиях.
Дата публикования: 2015-07-22; Прочитано: 1704 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
