 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Зависимость скорости реакции от температуры. Кроме концентрации и природы реагирующих веществ, важным фактором, определяющим скорость реакции, является температура
|
|
Кроме концентрации и природы реагирующих веществ, важным фактором, определяющим скорость реакции, является температура.
Константа скорости реакции есть функция от температуры; повышение температуры, как правило, увеличивает константу скорости. Первая попытка учесть влияние температуры была сделана Вант-Гоффом, сформулировавшим следующее эмпирическое правило.
При повышении температуры на каждые 10 градусов константа скорости элементарной химической реакции увеличивается в 2−4 раза.
Величина, показывающая, во сколько раз увеличивается скорость или константа скорости при повышении температуры на 10 градусов, есть температурный коэффициент скорости реакции γ. Математически правило Вант-Гоффа можно записать следующим образом:
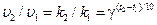 , (1.6)
, (1.6)
где g − температурный коэффициент скорости химической реакции;
k 1, k 2 – константы скорости реакции при соответствующих температурах;
t 1, t 2 – температуры реакций.
Однако правило Вант-Гоффа применимо лишь в узком температурном интервале, поскольку температурный коэффициент скорости реакции сам является функцией от температуры; при очень высоких и очень низких температурах температурный коэффициент γ становится равным единице (т.е. скорость химической реакции перестает зависеть от температуры).
Очевидно, что взаимодействие частиц осуществляется при их столкновениях; однако число столкновений молекул очень велико, и если бы каждое столкновение приводило к химическому взаимодействию частиц, то все реакции протекали бы практически мгновенно. С. Аррениус постулировал, что столкновения молекул будут эффективны (т.е. будут приводить к реакции) только в том случае, если сталкивающиеся молекулы обладают некоторым запасом энергии − энергией активации.
Энергия активации, Ea есть минимальная избыточная энергия, которой должны обладать молекулы, чтобы их столкновение могло привести к химическому взаимодействию. Энергию активации выражают в кДж/моль. Молекулы, обладающие такой энергией, называются активными молекулами.
Рассмотрим путь некоторой элементарной реакции: А+В → С. Поскольку химическое взаимодействие частиц связано с разрывом старых химических связей и образованием новых, то считается, что всякая элементарная реакция проходит через образование некоторого неустойчивого промежуточного соединения, называемого активированным комплексом. С ростом температуры число активных молекул возрастает. Отсюда следует, что и скорость химической реакции должна увеличиваться с повышением температуры. Действительно, при возрастании температуры химические реакции протекают быстрее (рисунок 1.2).
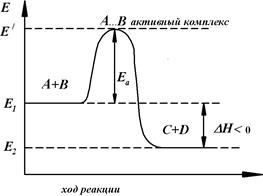
Координата реакции
Рисунок 1.2 − Энергетическая диаграмма химической реакции
E1 ‒ средняя энергия частиц исходных веществ, E2 ‒ средняя энергия частиц продуктов реакции;
Энергия активации Ea практически не зависит от температуры. Для каждой химической реакции характерно свое собственное значение Ea (не зависящее от температуры). В большинстве случаев энергия активации химических реакций между нейтральными молекулами составляет от 80 до 240 кДж/моль. Чем НИЖЕ активационный барьер Ea какой-либо химической реакции, тем БЫСТРЕЕ она идет в данных условиях, потому что большее число молекул А и Б способны преодолевать барьер в единицу времени.
Если в другой химической реакции активационный барьер ВЫШЕ, то такая реакция в тех же условиях идет МЕДЛЕННЕЕ. Если барьер очень высок, в системе вообще нет молекул, способных преодолеть активационный барьер и реакция не происходит.
Более точно зависимость скорости реакции от температуры описывает уравнение Аррениуса:
 , (1.7)
, (1.7)
где A − стерический фактор, который определяет вероятность активного столкновения;
Ea – энергия активации;
R – универсальная газовая постоянная;
T – температура реакции.
Как следует из (1.6), константа скорости реакции тем больше, чем меньше энергия активации.Величина Ea характеризует природу реагирующих веществ и определяется экспериментально из зависимости k = f (T). Записав уравнение (1.6) в логарифмическом виде и решая его для констант при двух температурах, находим Ea:
 ,
,
 . (1.8)
. (1.8)
Существуют реакции, которые замедляются при нагревании; их эффективная (полученная в результате измерения скорости процесса в целом) энергия активации отрицательна. В таких случаях стехиометрическое уравнение описывает сложный многостадийный процесс.
Для многих биологически важных реакций наблюдается ускорение процесса (отрицательная энергия активации) при замораживании водных растворов реагентов. Это объясняется возрастанием концентрации реагентов в жидких микровключениях, возникающих при медленном замораживании. В результате цикла изменения температуры замораживания пищевых продуктов от минус 5 oС до минус 18 oС («разморозка холодильника без оттайки») может быть вызвана быстрая порча.
Дата публикования: 2015-07-22; Прочитано: 1256 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
