 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
От концентрации
|
|
В 1867 г. был установлен закон действующих масс двумя норвежскими химиками К. Гульдбергом и П. Ваге.
При постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, возведенных в некоторых степенях:
А+В+2D = F+L,
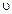 = k∙C A ∙C B ∙C D2, (1.5)
= k∙C A ∙C B ∙C D2, (1.5)
где k − коэффициент пропорциональности, называемый константой скорости данной реакции.
Физический смысл константы скорости заключается в том, что она равна скорости реакции при единичных концентрациях реагирующих веществ.
Константа скорости реакции k зависит от природы реагирующих веществ, температуры и катализатора, но не зависит от концентрации реагирующих веществ. Уравнение (1.4) называется кинетическим уравнением реакции.
Показатели степеней при концентрациях в кинетическом уравнении называются порядками реакции по данному веществу, а их сумма – общим порядком реакции. Порядки реакции устанавливаются экспериментально и в большинстве случаев не совпадают со стехиометрическими коэффициентами уравнений. Существует совсем немного реакций, где порядок совпадает с суммой стехиометрических коэффициентов.
N2O5= 2NO2+ 1/2O2  = k ∙ C (N2O5) реакция 1-го порядка
= k ∙ C (N2O5) реакция 1-го порядка
H2 + J2 = 2HJ  = k ∙ C (H2)∙ C (J2) реакция 2-го порядка
= k ∙ C (H2)∙ C (J2) реакция 2-го порядка
Cl2 +2NO = 2NOCl 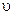 = k ∙ C (Cl2)∙ C (NO)2реакция 3-го порядка
= k ∙ C (Cl2)∙ C (NO)2реакция 3-го порядка
Порядок реакции может быть и дробным. Почему, рассмотрим ниже.
H2 + Br2 = 2HBr.
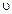 = kC H2 C Br2 ½.
= kC H2 C Br2 ½.
Реакции обычно идут по стадиям, поскольку невозможно представить себе одновременное столкновение большого числа молекул.
Предположим, что некая реакция
A + 2B = C + D.
идет по стадиям:
1) А + В = АВ.
2) АВ + В = C +D.
Тогда, если первая реакция идет медленно, а вторая быстро, то скорость определяется первой стадией (пока она не пройдет, не может идти вторая), т.е. накопление частиц АВ. Тогда и 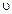 = k∙C A ∙C B.
= k∙C A ∙C B.
Скорость реакции для последовательных реакций определяется самой медленной стадией. Отсюда различие между порядком реакции и стехиометрическими коэффициентами. Например, реакция разложения перекиси водорода:
2H2O2 = 2H2O+O2.
На самом деле, реакция первого порядка, т.к. она лимитируется первой стадией H2O2 = H2O + O, а вторая стадия O + O = O2 идет очень быстро.
Может быть самой медленной не первая, а вторая или другая стадия, и тогда мы получаем иногда дробный порядок, выражая концентрации интермедиатов (промежуточных соединений) через концентрации начальных веществ.
Другая причина несовпадения порядка реакции с суммой стехиометрических коэффициентов уравнений − постоянство концентраций одного или нескольких участников реакции. Например, в реакции омыления эфира
C2H5COOCH3 + H2O = C2H5OH + CH3COOH.
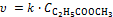 .
.
Молекулярность реакции – это число частиц, участвующих в элементарной реакции. В зависимости от молекулярности различают: мономолекулярные, би-, тримолекулярные реакции.
Дата публикования: 2015-07-22; Прочитано: 446 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
