 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Принцип Ле Шателье
|
|
Химическое равновесие всегда отвечает определенным условиям. При изменении внешних параметров (температуры, концентрации, в некоторых случаях – давления) равновесие может нарушиться. Через некоторое время наступает состояние равновесия, отвечающее новым условиям. Возникающее при этом изменение равновесных концентраций реагирующих веществ называется смещением или сдвигом химического равновесия.
В 1884 г. Ле Шателье сформулировал принцип, который помогает качественно предсказать смещение химического равновесия при изменении одного из параметров:
Если на систему, находящуюся в состоянии химического равновесия, оказано внешнее воздействие, то равновесие сместится в направлении той реакции, которая ослабляет это воздействие
Факторы, влияющие на смещение химического равновесия:
1) Концентрация веществ:
N2 + 3H2 ⇄ 2NH3, DH0р-и = -92 кДж
При увеличении концентрации равновесие смещается в направлении расхода этих веществ.
При уменьшении концентрации равновесие смещается в направлении образования этих веществ.
Если увеличить концентрацию азота, то равновесие сместится в прямом направлении, а если увеличить концентрацию аммиака - в обратном.
2) Давление.
Влияет только на газообразные вещества.
При повышении давления равновесие смещается в направлении реакции, идущей с уменьшением числа частиц газообразных веществ.
При уменьшении давления равновесие смещается в направлении реакции, идущей с увеличением числа частиц газообразных веществ.
Если увеличить давление, то равновесие сместится в прямом направлении, а если уменьшить - в обратном.
3) Температура.
При повышении температуры равновесие смещается в направлении эндотермической реакции.
При понижении температуры равновесие смещается в направлении экзотермической реакции.
Если увеличить температуру, то равновесие сместится в обратном направлении, а если уменьшить - в прямом.
4) Катализатор.
Введение в равновесную систему катализатора не смещает равновесие, так как катализатор в равной степени увеличивает скорость как прямой, так и обратной реакции. Катализатор только ускоряет момент наступления химического равновесия.
Пример 1. Для реакции АТФ + АМФ ⇄ 2АДФ DG0р-и = -2,1 кДж/моль. Определить, является ли при 298 K реакция обратимой, направление смещение равновесия и равновесный состав системы.
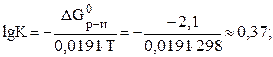
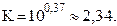
K = 2,34 > 1, следовательно реакция является практически обратимой и равновесие смещено вправо.
Обозначим С0(АТФ) = С0(АМФ) = а, а количество прореагировавшего АТФ - х. Тогда:
[АДФ] = 2 x;
[АТФ] = a – x;
[АТФ] = a – x;
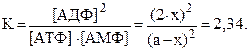
Решая квадратное уравнение, получим: x/a = 0,433, т.е. при любом значении a превращению подвергается 43,3% исходного вещества.
Пример 2. Для реакции:
L-глутаминовая кислота + пируват ⇄ α-кетоглутаровая кислота + L-аланин
константа равновесия при 300 K равна 1,11. В каком направлении будет протекать реакция при следующих концентрациях реагентов: С(L-Glm) = C(Pir) = 0,00003 M; С(α-KGlu) = C(L-Ala) = 0,005 M?
Запишем уравнение изотермы Вант-Гоффа, подставив вместо DG0р-и выражение -R×T×lnKc:

DG > 0, следовательно реакция протекает в обратном направлении.
Дата публикования: 2015-07-22; Прочитано: 190 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
