 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Кинетика равновесных процессов
|
|
С течением времени скорость прямой реакции снижается, а скорость обратной реакции - возрастает.

Так, для гомогенной реакции:
aA + bB ⇄ cC + dD
скорость прямой реакции: 
скорость обратной реакции: 
Химическое равновесие - это состояние системы, при котором скорости прямой и обратной реакций равны. Иными словами, кинетическим критерием состояния химического равновесия является равенство скоростей прямой и обратной реакций.
Таким образом, в состоянии химического равновесия мы имеем:
 .
.
Данное соотношение можно преобразовать следующим образом:
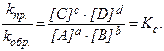
В данном случае величина Kс – константа химического равновесия – заменяет собой отношение двух постоянных величин kпр. и kобр.. Взаимосвязь константы равновесия с равновесными концентрациями представляет собой выражение закона действующих масс для равновесных систем.
Константа равновесия зависит от природы веществ и от температуры, но не зависит от концентрации веществ и от наличия катализатора.
В выражение для константы равновесия входят только концентрации веществ, находящихся в жидком или газообразном состоянии.
С тв + СО2 газ ⇄ 2СО газ
Kc = [CO]2/[CO2].
В случае газообразных веществ константа равновесия Kp выражается через равновесные парциальные давления газов:
2NO + O2 ⇄ 2NO2,
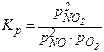 .
.
Несложно видеть, что между константой равновесия, выраженной через равновесные концентрации (KC) и через парциальные давления (KP), существует взаимосвязь:
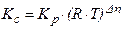 ,
,
где Dn – разность числа молекул между левой и правой частями уравнения.
По величине K можно судить о том, в каком направлении смещено равновесие.
Если K > 1, равновесие смещено в прямом направлении, если K < 1, то равновесие смещено в обратном направлении.
DG0р-и = -2,3×R×T×lgKc
Отсюда:
Если K > 1, то  < 0 и реакция идет в прямом направлении, если
< 0 и реакция идет в прямом направлении, если  > 0, то K < 1 и исходные вещества практически не взаимодействуют друг с другом.
> 0, то K < 1 и исходные вещества практически не взаимодействуют друг с другом.
Дата публикования: 2015-07-22; Прочитано: 178 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
