 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Система с неограниченной растворимостью в жидком и отсутствием растворимости в твердом состоянии
|
|
На рис. 1 представлена простейшая диаграмма состояния двухкомпонентной системы, в которой компоненты А и В в жидком состоянии растворяются друг в друге в любых отношениях, а в твердом состоянии совсем не образуют растворов.
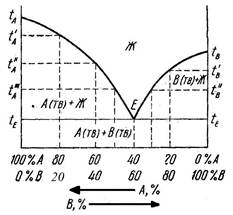
Рис. 1. Диаграмма состояния с полной растворимостью в жидком состоянии и отсутствием растворимости в твердом состоянии
Точка tAсоответствует температуре плавления чистого вещества А. Выше этой температуры существует только жидкое вещество А, а ниже – только твердое тело А. Из теории растворов известно, что температура замерзания, или, что то же самое, температура плавления вещества понижается при добавлении другого, растворяющегося в нем вещества. Поэтому температура плавления смеси А и В, содержащей, например 20 % В, будет ниже tA и составит t'A.
По мере увеличения концентрации В температура плавления смеси будет понижаться, например, при 40 % В она составит t"A. Очевидно, что при температурах выше точек tA, t'Aи t"A существует лишь однородная жидкость – раствор вещества В в А. При указанных температурах плавления из этого раствора, который становится насыщенным относительно вещества А, начинают выделяться его кристаллы, не содержащие В (из-за полного отсутствия растворимости вещества В в А в твердом состоянии). Ниже температур t'A, t''A наряду с кристаллами А продолжает существовать и жидкость. Однако ее состав по мере понижения температуры вследствие выделения из нее вещества Аизменяется – в ней увеличивается концентрация компонента В. Поэтому при дальнейшем понижении температуры и росте содержания В при некоторой температуре tE наступает насыщение раствора относительно не только вещества А, но и В. При этой температуре из жидкости начинают одновременно выделяться кристаллы А и В (кристаллы В также не содержат вещества А). Из диаграммы видно, что такая одновременная кристаллизация обоих веществ происходит лишь при одной определенной температуре tE и определенном составе раствора (40 % А+60 % В). Ниже этой температуры жидкость полностью исчезает и остается только смесь кристаллов А и В. Итак, рассмотрена часть диаграммы, относящаяся к выделению кристаллов А из расплава. Подобный же вид имеет и другая часть диаграммы. При температуре tB происходит плавление чистого вещества В. Добавление к нему вещества А снижает температуру его плавления. Раствор, содержащий 20 % А, плавится при температуре t'B. При температуре tE раствор, который был насыщен веществом В, насыщается и компонентом А, в результате начинается одновременная кристаллизация двух веществ.
Таким образом, диаграмму можно разделить на четыре области. Первая область лежит выше двух ветвей tAE и tBE и представляет собой жидкость, в которой оба вещества А и В растворены друг в друге. Выше точки tA состав жидкости может изменяться от 0 до 100 % А. Применение правила фаз показывает, что эта область характеризуется двумя степенями свободы (С = К–Ф+1 = 2–1+1 = 2), т. е. здесь можно одновременно изменять и температуру, и состав раствора, при этом новые фазы не появятся. Кривые tAE и tBE называются линиями ликвидус (ликвидус по латыни означает «жидкость»), так как они ограничивают область однородной жидкости. При достижении температур и составов, отвечающих этим линиям, начинается выделение кристаллов А или В, т. е. линии tAE и tBE соответствуют равновесию между двумя фазами — жидкой и твердой. При появлении второй фазы число степеней свободы становится равным единице (С = 2–2+1 = 1). Это означает невозможность одновременного изменения температуры и состава при условии сохранения равновесия между двумя фазами. В этих условиях достаточно задать один из параметров, например температуру, чтобы второй параметр (состав) получил бы вполне определенное значение. Так, температуре t"'A соответствует состав жидкости, равновесной с кристаллами А (50 % А), а температура t"B характеризует состав жидкости, равновесной с кристаллами В.
При понижении температуры до tE слева от точки Е, кроме жидкости и кристаллов А, появляется третья фаза — кристаллы В и число степеней свободы падает до куля (С = 2–3+1 = 0). Это означает, что три фазы могут сосуществовать лишь при единственной температуре tE, при единственном составе жидкости, отвечающем точке Е. Этот состав называется эвтектическим. Как видно из рис. 1, жидкость эвтектического состава отличается самой низкой температурой затвердевания по сравнению с любыми другими смесями веществ А и В. Это свойство эвтектических смесей используется для приготовления легкоплавких сплавов и припоев. Ниже температуры tE жидкость уже не может существовать и охлаждаемый сплав состоит только из двух твердых фаз А и В. Подобная картина наблюдается и справа от точки Е при температуре tE, где к двум фазам – жидкости и кристаллам В добавляются кристаллы А. Очевидно, и здесь жидкость имеет состав, отвечающий точке Е. Ниже горизонтальной линии tEEtE жидкость уже не может существовать. Эта линия называется линией солидус (солидус – твердое тело). К этой области правило фаз уже не применимо, так как кристаллы А и В представляют собой механическую смесь и равновесия между ними не существует.
Диаграммы состояния, подобные рассмотренной выше, образуют, например, серебро и свинец, окись кальция и окись магния, а также некоторые другие системы. Однако полная взаимная нерастворимость двух веществ в твердом состоянии встречается сравнительно редко. Чаще наблюдается образование более или менее ограниченных твердых растворов.
Дата публикования: 2015-07-22; Прочитано: 712 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
