 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Влияние температуры. В соответствии с принципом Ле-Шателье, если на систему, находящуюся в равновесии, воздействовать извне путем изменения какого-либо условия
|
|
В соответствии с принципом Ле-Шателье, если на систему, находящуюся в равновесии, воздействовать извне путем изменения какого-либо условия, то в системе усилится такой процесс, течение которого ослабит влияние произведенного воздействия.
Рассмотрим две реакции:
- экзотермическую обратимую реакцию окисления сернистого ангидрида  , где за счет выделения тепла растет температура, увеличивается скорость обратной реакции и равновесие сдвигается влево. Для увеличения выхода
, где за счет выделения тепла растет температура, увеличивается скорость обратной реакции и равновесие сдвигается влево. Для увеличения выхода 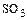 от системы необходимо отводить тепло;
от системы необходимо отводить тепло;
- эндотермическую обратимую реакцию: конверсию метана водяным паром  , для сдвига равновесия такой реакции в сторону продуктов необходимо к системе подводить тепло.
, для сдвига равновесия такой реакции в сторону продуктов необходимо к системе подводить тепло.
Равновесная степень превращения зависит от константы равновесия
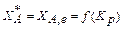 . (3.8)
. (3.8)
Для реакций можно получить аналитические зависимости
A 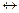 R
R 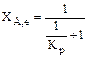 ; (3.9)
; (3.9)
A 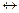 2R
2R 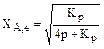 ; (3.10)
; (3.10)
где р – общее давление.
Влияние температуры на равновесие, т.е. функциональная зависимость 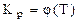 отражается уравнением изобары Вант-Гоффа:
отражается уравнением изобары Вант-Гоффа:
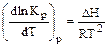 . (3.11)
. (3.11)
Принимаем, что в температурном диапазоне Т1-Т2 изменение энтальпии 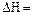 const.
const.
После интегрирования
 , (3.12)
, (3.12)
где В1 – константа интегрирования.
В действительности изменение энтальпии 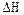 в диапазоне Т1-Т2 зависит от температуры, поэтому пользуются эмпирическим уравнением
в диапазоне Т1-Т2 зависит от температуры, поэтому пользуются эмпирическим уравнением
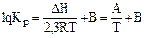 , (3.13)
, (3.13)
где А, В – коэффициенты, которые можно найти в справочной литературе.
ХА,е= Ф(Т). (3.14)
Эта зависимость различна для реакций эндо- и экзотермических (рисунок 3.1).
|
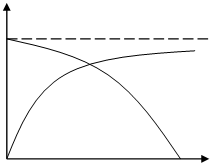
Т
Рисунок 3.1 – Зависимость равновесной степени
превращения от температуры
Дата публикования: 2014-10-07; Прочитано: 434 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
