 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Уравнение изотермы и направление химической реакции. Принцип смещения равновесия Ле Шателье - Брауна
|
|
Анализ уравнения изотермы химической реакции позволяет определить условия, при которых реакция может протекать в заданном направлении. Самопроизвольное протекание реакции возможно, когда DGP,T<0.
Из уравнения изотермы химической реакции (3.12) следует, что величина и знак DGP,T реакции зависят от соотношения  и
и  :
:
при  <
<  DGP,T <0, - необратимый самопроизвольный процесс, т.е.реакция (3.1) идет самопроизвольно в прямом направлении;
DGP,T <0, - необратимый самопроизвольный процесс, т.е.реакция (3.1) идет самопроизвольно в прямом направлении;
при  >
>  DGP,T >0, - необратимый не самопроизвольный процесс, т.е. в данных условиях реакция может протекать самопроизвольно только в обратном направлении;
DGP,T >0, - необратимый не самопроизвольный процесс, т.е. в данных условиях реакция может протекать самопроизвольно только в обратном направлении;
при  =
=  DGP,T=0, - реакция находится в состоянии химического равновесия.
DGP,T=0, - реакция находится в состоянии химического равновесия.
Таким образом, если известна константа равновесия реакции и начальное содержание реагентов в системе, можно расчетным путем предсказать направление реакции или возможность ее осуществления в заданном направлении. Мы еще раз убедились в том, что изменение изобарного потенциала в ходе реакции характеризует реакционную способность веществ, т.е. является мерой химического сродства.
При изменении внешних условий химическое равновесие смещается. Направление смещения равновесия определяется принципом смещения равновесия Ле Шателье - Брауна: если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие, изменив какой-либо параметр, то в системе произойдет такое смещение равновесия, которое ослабит это воздействие.
Рассмотрим реакцию:

 N2+3H2 2NH3 (3.25)
N2+3H2 2NH3 (3.25)
Из 4-х молей исходных веществ образуется 2 моля продукта реакции, т.е. реакция идёт с уменьшением числа молей газообразных веществ, Δν = 2 – 4 = -2.
На качественном уровне, применяя принцип смещения равновесия Ле Шателье – Брауна, можно установить следующее. Уменьшение числа молей в ходе реакции уменьшает общее давление в системе (при постоянном объеме) или уменьшает объем (при постоянном давлении). Это значит, что если в системе постоянного объема увеличить общее давление, то равновесие реакции сместится вправо, выход продуктов реакции увеличится, а количество исходных веществ уменьшится.
Обоснование принципа смещения равновесия может быть дано и с позиций термодинамики.
В соответствии с уравнением (3.23), КN = KP · P-Dn. Константа равновесия, выраженная через молярные доли компонентов, зависит от общего давления в системе. Поскольку Δν < 0, то увеличение общего давления Р приведет к увеличению КN, что означает сдвиг равновесия реакции вправо и увеличение содержания аммиака. При этом КР не изменится. Очевидно, что аналогичные рассуждения о реакции, идущей с увеличением числа молей продуктов реакции, приведут к противоположному выводу: если Δν > 0, то увеличение общего давления сместит равновесие влево, и содержание продуктов реакции уменьшится.
Давление является одним из важнейших факторов, позволяющих осуществлять синтез веществ с максимально возможным выходом продуктов. Так, например, синтез аммиака в промышленности ведут при давлениях порядка 107 Па и температурах 750 – 900 К. Если уменьшить давление в системе до атмосферного, то выход продукта уменьшится примерно в 70 раз.
Если к смеси компонентов, участвующих в реакции, протекающей в газовой фазе, добавить постороннюю примесь, например, инертный газ, не увеличивая при этом общее давление в системе, то поскольку КN не изменится (ввиду постоянства Р), а общее число молей веществ в смеси Σni вырастет, то при Δν > 0 должно вырасти и число молей продуктов реакции. При Δν < 0 влияние будет противоположно. К такому выводу приводит анализ уравнения для константы равновесия, выраженной через молярные доли:
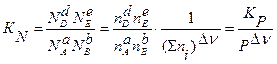 (3.26)
(3.26)
Дата публикования: 2014-09-25; Прочитано: 1146 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
