 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Химические свойства оснований
|
|
Растворы щелочей - мыльные на ощупь и меняют окраску индикаторов:
а) фиолетовый лакмус - в синий цвет,
б) бесцветный раствор фенолфталеина - в малиновый цвет.
1. Большинство малорастворимых оснований при нагревании легко разлагаются на оксид и воду:
Сu(ОН)2 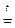 СuО + Н2О
СuО + Н2О
Sn(OH)2 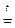 SnO + Н2О
SnO + Н2О
Основания щелочных металлов термически устойчивы. Так, гидроксид натрия NaОН кипит при Т = 1400oC без разложения.
2. Основания взаимодействуют с кислотами (реакция нейтрализации), образуя соль и воду:
Например:
NaОН + НС1 = NaС1 + Н2О
Сu(ОН)2 + Н2SO4 = СuSO4 + 2H2O
Мg(ОН)2 + 2НNO3 = Мg(NO3)2 + 2Н2О.
3. Основания взаимодействуют с кислотными оксидами:
Са(ОН)2 + СO2 = СаСО3 ↓+ Н2О
Ва(OH)2 + SO3 = ВаSO4 ↓+ Н2О
6NaОН + Р2О5 = 2NaЗPO4 + 3H2O
4. Растворимые в воде основания (щелочи) взаимодействуют с амфотерными оксидами, образуя при сплавлении соответствующие соли:
Al2O3 + 2NaOH 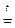 NаА1O2 + Н2О
NаА1O2 + Н2О
ZnO + 2КОН 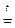 K2ZnO2 + H2O
K2ZnO2 + H2O
При взаимодействии амфотерных оксидов с растворами щелочей образуются гидроксокомплексы.
ZnO + 2КОН + H2O 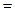 K2[Zn(OH)4]
K2[Zn(OH)4]
5. Щелочи взаимодействуют с растворами солей, образуя новое основание и новую соль:
2NaОН + СuSО4 = Сu(ОH)2 ↓+ Na2SО4
ЗNH4ОН + АlСl3 = А1(ОН)3 ↓+ 3NH4Cl
2КОН + МnС12 = Мn(ОН)2 ↓+ 2КС1
Дата публикования: 2014-10-19; Прочитано: 492 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
