 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Белки, их строение и функции
|
|
Белки — это высокомолекулярные соединения, биополимеры, мономерами которых являются аминокислоты, связанные пептидными связями.
Аминокислотой называют органическое соединение, имеющее аминогруппу, карбоксильную группу и радикал (рис. 2.12). Всего в природе встречается около 200 аминокислот, которые различаются радикалами и взаимным расположением функциональных групп, но только 20 из них могут входить в состав белков. Такие аминокислоты называют протеиногенными.
К сожалению, не все протеиногенные аминокислоты могут синтезироваться в организме человека, поэтому их делят на заменимые и незаменимые.
Заменимые аминокислоты образуются в организме человека в необходимом количестве, а незаменимые — нет. Они должны поступать с пищей, но могут и частично синтезироваться микроорганизмами кишечника. Полностью незаменимых аминокислот насчитывается 8. К ним относятся валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан и фенилаланин. Несмотря на то, что в растениях синтезируются абсолютно все протеиногенные аминокислоты, растительные белки являются неполноценными, поскольку не содержат полного набора аминокислот, к тому же наличие белка в вегетативных частях растений редко превышает 1-2% массы. Поэтому необходимо употреблять в пищу белки не только растительного, но и животного происхождения.

Последовательность из двух аминокислот, связанных пептидными связями (рис. 2.13), называется дипептидом, из трех — трипептидом и т. д. Среди пептидов встречаются такие важные соединения, как гормоны (окситоцин, вазопрессин), антибиотики и др. Цепочка из более чем десяти аминокислот называется полипептидом, а полипептиды, содержащие более 50 аминокислотных остатков, — это белки.
Уровни структурной организации белка. Белки могут иметь первичную, вторичную, третичную и четвертичную структуры.
Первичная структура белка — это последовательность аминокислот, соединенных пептидной связью (рис. 2.14). Первичная структура в конечном итоге определяет специфичность белка и его уникальность, поскольку, если даже предположить, что в среднем белок содержит 500 аминокислотных остатков, то число их возможных комбинаций составляет 20 500. Поэтому изменение расположения хотя бы одной аминокислоты в первичной структуре влечет за собой изменение вторичной и более высоких структур, а также свойств белка в целом.

Особенности строения белка обусловливают его пространственную укладку — возникновение вторичной и третичной структур.
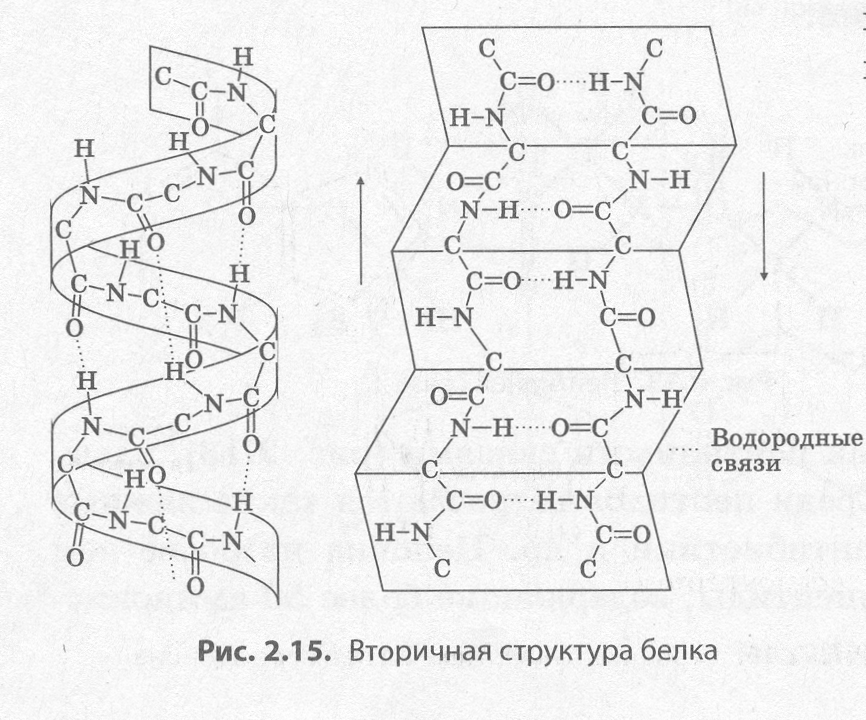
Вторичная структура представляет собой пространственную укладку белковой молекулы в виде спирали или складок, удерживаемой водородными связями между атомами кислорода и водорода пептидных группировок разных витков спирали или складок (рис. 2.15). Многие белки содержат более-менее длинные участки со вторичной структурой. Это, например, кератины волос и ногтей, фиброин шелка.
Третичная структура белка также является формой пространственной укладки полипептидной цепи, удерживаемой гидрофобными, водородными, дисульфидными (S—S) и другими связями (рис. 2.16). Она характерна для большинства белков организма, например миоглобина мышц.
Четвертичная структура — наиболее сложная, образованная несколькими полипептидными цепями, соединенными в основном теми же связями, что и в третичной (гидрофобными, ионными и водородными), а также иными слабыми взаимодействиями (рис. 2.17). Четвертичная структура характерна для немногих белков, таких как гемоглобин, хлорофилл и др.
По форме молекулы различают фибриллярные и глобулярные белки. Первые из них вытянуты, как, например, коллаген соединительной ткани или кератины волос и ногтей. Глобулярные же белки имеют форму клубка (глобулы), как миоглобин мышц.
Простые и сложные белки. Белки могут быть простыми и сложными. Простые белки состоят только из аминокислот, тогда как сложные белки (липопротеины, хромопротеины, гликопротины, нуклеопротеины и др.) содержат белковую и небелковую части. Хромопротеины содержат окрашенную небелковую часть. К ним относятся гемоглобин, миоглобин, хлорофилл, цитохромы и др.

Так, в составе гемоглобина каждая из четырех полипептидных цепей белка глобина связана с небелковой частью — гемом, в центре которого находится ион железа, придающий гемоглобину красную окраску. Небелковой частью липопротеинов является липид, а гликопротеинов — углевод. Как липопротеины, так и гликопротеины входят в состав клеточных мембран. Нуклеопротеины представляют собой комплексы белков и нуклеиновых кислот (ДНК и РНК). Они выполняют важнейшие функции в процессах хранения и передачи наследственной информации.
Свойства белков. Многие белки хорошо растворимы в воде, однако есть среди них и такие, которые растворяются только в растворах солей, щелочей, кислот или органических растворителях. Структура молекулы белка и его функциональная активность зависят от условий окружающей среды. Утрата белковой молекулой своей структуры, вплоть до первичной, называется денатурацией (рис. 2.18).
Денатурация происходит вследствие изменения температуры, рН, атмосферного давления, под действием кислот, щелочей, солей тяжелых металлов, органических растворителей и т. п. Обратный процесс восстановления вторичной и более высоких структур называется ренатурацией, однако он не всегда возможен. Полное разрушение белковой молекулы называется деструкцией.
Белки выполняют в клетке ряд функций: пластическую (строительную), каталитическую (ферментативную), энергетическую, сигнальную (рецепторную), сократительную (двигательную), транспортную, защитную, регуляторную и запасающую.
Строительная функция белков связана с их наличием в клеточных мембранах и структурных компонентах клетки. Энергетическая — обусловлена тем, что при расщеплении 1 г белка высвобождается 17,2 кДж энергии. Белки-рецепторы мембран принимают активное участие в восприятии сигналов окружающей среды и их передаче по клетке, а также в межклеточном узнавании. Без белков невозможно движение клеток и организмов в целом, так как они составляют основу жгутиков и ресничек, а также обеспечивают сокращение мышц и перемещение внутриклеточных компонентов. В крови человека и многих животных белок гемоглобин переносит кислород и часть углекислого газа, другие белки транспортируют ионы и электроны. Защитная роль белков связана, в первую очередь, с иммунитетом, поскольку белок интерферон способен уничтожать многие вирусы, а белки-антитела подавляют развитие бактерий и иных чужеродных агентов. Среди белков и пептидов немало гормонов, например, гормон поджелудочной железы, инсулин, регулирующий концентрацию глюкозы в крови. У некоторых организмов белки могут откладываться в запас, как у бобовых в семенах, или белки куриного яйца.

Дата публикования: 2014-10-19; Прочитано: 3163 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
