 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Гемфри Дэви
|
|
ризонтально в сухих узких деревянных ящичках. Батарея состояла из трёхметровых рядов, соединённых последовательно медными скобками. Теоретически подобное устройство из 2100 мелно-цинковых пар может давать напряжение до 2500 вольт (В). Обслуживание батареи было очень трудоёмким. В ходе опытов пластины окислялись, и их приходилось регулярно чистить, естественно вручную. За час один работник мог осилить только 40 пластин, а на то, чтобы привести батарею в готовность к следующим опытам, у него ушло бы не меньше двух недель.
Тем не менее, используя свою гигантскую батарею, Петров провёл множество экспериментов: он разлагал током различные вещества, в том числе органические, а также оксиды металлов — ртути, свинца и олова. В 1803 г. учёный впервые в мире получил электрическую дугу и нашёл ей практическое применение — плавил металлы, ярко освещал большие помещения. «Если на
стеклянную плитку или на скамеечку со стеклянными ножками, — писал Петров, — будут положены два или три древесных угля... и если потом металлическими изолированными направлятелями (directores), сообщёнными с обоими полюсами огромной батареи, приближать оные один к другому на расстояние от одной до трёх линий (линия — старинная мера длины, равная 0,1 дюйма, т. е. 2,54 мм; отсюда, кстати, название знаменитой трёхлинейной винтовки калибра 7,62 мм. — Прим. ред.), то является между ними весьма яркий белого цвета свет или пламя, от которого оные угли скорее или медлительнее загораются, и от которого тёмный покой довольно ясно освещён быть может».
Работы Петрова поставили его в один ряд с выдающимися учёными начала XIX в. В 1803 г. он был избран членом-корреспондентом, а в 1809 г. — академиком Петербургской академии наук. Современники отмечали замечательный преподавательский дар физика. Однако руководство Медико-хирургической академии явно недооценивало учёного (возможно, тут сказалось его «низкое» происхождение — Петров родился в семье священника в Белгородской губернии). В 1827 г. его отстранили от руководства физическим кабинетом. Труды Петрова, опубликованные только на русском языке, оставались неизвестными за границей. Так, многие физики считали, что первым электрическую дугу получил Дэви, и даже в отечественных учебниках физики она называлась вольтовой.
Ещё долгое время физики состязались в том, кто построит самую мощную батарею. «Рекорд» по числу соединённых между собой гальванических элементов принадлежит, вероятно, англичанину Дж. Зингеру, который в 1813 г. описал батарею, состоящую из 20 тыс. серебряно-цинковых пар. Однако из-за очень большого внутреннего сопротивления она не могла давать даже ток, способный разложить воду.
ЭЛЕКТРОЛИЗ В ВОДНЫХ РАСТВОРАХ
Электролиз широко используют в промышленности для синтеза разнообразных продуктов. Регулируя температуру и силу тока, можно сравнительно просто управлять скоростью и направлением этого процесса. Электролизом водных растворов в огромных количествах получают водород и кислород, хлор и его диоксид, гидроксид натрия, хлораты (соли хлорноватой кислоты НСlО3) и перхлораты (соли хлорной кислоты НСlО4), такие металлы, как медь, свинец, олово, кобальт, никель и др. Электролитическим методом наносят декоративные и защитные покрытия из драгоценных металлов, никеля, хрома (гальванические покрытия). Электролиз расплавов даёт щелочные и шёлочно-земельные металлы, алюминий, магний и др. В органической химии различные соединения получают восстановлением на катоде или окислением на аноде; при этом часто используют неводные растворители.
Механизм многих процессов электролиза водных растворов может быть довольно сложным. Внешний источник напряжения как бы перекачивает электроны от анода к катоду, поэтому на катоде происходят реакции присоединения электронов (восстановление), а на аноде — реакции отдачи электронов (окисление). Если на электродах не будут идти окислительно-восстановительные реакции, ток через раствор вообще не пойдёт. Ведь именно в ходе электродных реакций электроны переходят с катода в раствор, а из раствора — на анод, замыкая таким образом электрическую цепь. В растворе же ток переносится не электронами, а ионами.
При электролизе водных растворов солей металлов их ионы могут восстанавливаться и давать свободные металлы. Поскольку на электроды можно подавать большое напряжение, катод по праву считается самым сильным восстановителем, а анод — самым сильным окислителем. Не все металлы можно таким образом выделить из раствора. Наиболее активные из них реагируют с водой и в её растворе образоваться
не могут. Но кроме ионов металлов на катоде способны восстанавливаться и молекулы воды: 2Н2О+2е=Н2+2ОН-. По способности к восстановлению молекулы воды занимают место примерно между ионами Аl3+ и Zn2+. Поэтому при электролизе солей активных металлов (от лития до алюминия включительно) вместо металлов на катоде выделяется только водород.
Катионы от Mn2+ до Pb2+ могут восстанавливаться с выделением металла. Но если их концентрация в растворе мала, то одновременно с металлом в большей или меньшей степени на катоде выделяется и водород.
Катионы, стоящие в ряду напряжений после водорода, легко выделяются при электролизе, а вода при этом не восстанавливается. Если в растворе присутствуют соли разных металлов, то при равной их концентрации прежде всего будут восстанавливаться ионы, стоящие правее в указанном ряду.
Если в растворе есть свободная кислота, где велика концентрация ионов Н+, восстанавливаться будут именно они. Но в нейтральных растворах концентрация ионов Н+ настолько мала (примерно 10-7 моль/л), что скорость их восстановления значительно меньше, чем восстановления молекул воды.
Некоторые процессы катодного восстановления весьма необычны. Вот лишь два примера. При электролизе холодного водного раствора хлорида аммония с ртутным катодом образуется амальгама аммония —твёрдое вещество, устойчивое только при низких температурах. При комнатной температуре оно приобретает консистенцию пасты и постепенно разлагается: 2NH4Hgx= 2xHg+2NH3+Н2. Так что амальгамы, т. е. сплавы с ртутью, могут давать не только металлы. Оказывается, аммоний тоже на это способен. Раньше полагали, что в амальгаме аммония действительно есть незаряженные группы NH4, похожие по свойствам на свободные атомы щелочных металлов. Потом выяснилось, что в амальгаме всё-таки присутствуют обычные ионы аммония NH+4 они легко встраиваются между атомами ртути, так как радиусы атомов ртути и ионов NH+4 близки. А чтобы в
целом амальгама была электрически нейтральной, положительные заряды ионов аммония в ней компенсируются свободными электронами, которые ртутный электрод приобретает в процессе электролиза.
Второй пример — образование так называемой взрывчатой сурьмы при электролизе раствора SbCl3. На катоде осаждается серебристо-белое вещество с металлическим блеском; его плотность (примерно 5,8 г/см3) меньше, чем у обычной сурьмы (6,65 г/см3). При трении или ударе эта модификация сурьмы взрывается, превращаясь в порошок обычной сурьмы.
Более сложны и весьма разнообразны процессы, протекающие в ходе электролиза водных растворов на аноде. Обычно не окисляются на аноде анионы кислородсодержащих кислот: SO2-4, NO-3, PO3-4, СО2-3. Вместо них окислению подвергаются молекулы воды с выделением кислорода: 2Н2О-4е=О2+4Н+. В нейтральных растворах этот процесс идёт со значительно большей скоростью, чем окисление гидроксид-анионов: 4ОН--4е=О2+2Н2О. Последняя реакция преобладает только при высоких концентрациях ионов ОН-, т. е. при электролизе растворов щелочей. Некоторые анионы, например SO2-3, легко окисляются на аноде до сульфат-анионов. При очень высокой концентрации в растворе (более 500 г/л) возможно анодное окисление и сульфат-ионов: 2SO2-4-2е=S2O2-8. На этой реакции основано промышленное получение пероксодисерной (надсерной) кислоты H2S2O8 электролизом крепких растворов серной кислоты. С помощью надсерной кислоты и её солей вырабатывают пероксид водорода. Аналогично электролизом тетрабората натрия Na2B4O7 (буры) получают пероксидное соединение бора — пероксоборат натрия NaH2BO4. Его применяют как отбеливатель, добавляют в моющие и дезинфицирующие средства.
Анионы галогеноводородных кислот (кроме F-) в водных растворах легко окисляются на аноде, образуя соответствующие галогены. Они могут выделяться в свободном состоянии, а также реагировать с другими веществами, осо-
бенно если раствор перемешивать. Например, при электролизе водного раствора поваренной соли с пористой диафрагмой между катодом и анодом, препятствующей перемешиванию, на катоде протекает процесс 2Н2О+2е=Н2+2ОН-, а на аноде 2Cl--2е = Сl2. Так получают хлор (а заодно и водород). Если же не отделять катодное пространство от анодного, раствор будет перемешиваться, а хлор — реагировать с щёлочью, которая накапливается около катода. Тогда в результате электролиза поваренной соли при 0 °С получим гипохлорит натрия NaOCl, а при повышенной температуре — хлорат натрия NaCIO3.
До сих пор рассматривались реакции, протекающие с так называемыми инертными электродами (графит, титан, платина и т. п.). Особый случай представляют при электролизе процессы на химически активных (растворимых) анодах, когда вместо окисления растворённого вещества может идти окисление самого анода, например Cu-2е=Cu2+. При электролизе таких солей, как Na2SO4, реакция идёт значительно быстрее, чем окисление молекул воды, и кислород на аноде не выделяется.
Значительный практический интерес представляет электролиз растворов солей меди (в частности, CuSO4) с медными электродами. В этом случае на аноде окисляются и переходят в раствор в виде ионов атомы меди, а на катоде те же ионы восстанавливаются и в виде металла осаждаются на электроде. Такая «перегонка» меди с анода на катод отнюдь не бессмысленна. Часто выплавляемая из руд медь содержит примеси. Если из этой мели сделать аноды и «перегнать» их электрохимически (через раствор CuSO4) на катод, то произойдёт очистка металла (так называемое электролитическое рафинирование). Высокочистая медь необходима во многих случаях, например для изготовления проводов. Одновременно используются и не перешедшие из анода в раствор примеси — так называемый анодный шлам. Он нередко бывает обогащён драгоценными металлами (в том числе и золотом), и их выделение может, по крайней мере частично, окупить затраты на рафинирование меди. В промышленности применяют и другие растворимые аноды. Так, анодным растворением сплава железа и марганца можно получить перманганат калия.
металлический натрий в виде мелких шариков поднимался на поверхность расплава; здесь он воспламенился, и произошёл взрыв. Осколки стекла попали учёному в глаза. Несмотря на то что на один глаз Дэви ослеп, его энтузиазм и преданность науке не уменьшились, и он сделал ещё много открытий.
Таковы были практические результаты электрохимии. Хуже обстояло дело с теорией, с толкованием полученных результатов.
СЕКРЕТЫ ЭЛЕКТРОЛИЗА
Что происходит в растворе при прохождении электрического тока? Как связано электричество с веществом? Почему при электрохимическом разложении воды водород и кислород выделяются на разных полюсах?
Многие из этих вопросов суждено было решить великому английскому физику и химику Майклу Фарадею. Он прежде всего выяснил, имеет ли электричество, полученное от разных источников, одну и ту же природу. Учёный установил, что электричество, возникающее при трении веществ (например, в электрофорной машине), а также полученное в гальванической батарее, магнитоэлектричество, «животное» электричество (например, от электрического ската), термоэлектричество тождественны по своей природе и различаются лишь количественно — мощностью и напряжением.
Фарадей придумал для новой науки исключительно удачные термины. Согласно Фарадею, процессы элек-
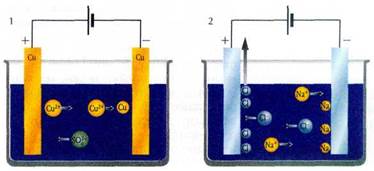
1 — электролиз раствора CuSO4
Дата публикования: 2014-11-18; Прочитано: 486 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
