 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Тема VII. Гравиметрический анализ. Образование осадков. Понятие весовой формы и формы осаждения. Расчеты в гравиметрическом анализе
|
|
Основной задачей гравиметрического анализа, как и титриметрических методов, является определение количественного состава вещества или смеси веществ. Изучая особенности гравиметрического анализа, следует хорошо усвоить общую схему проведения анализа, в основе которого лежит превращение исследуемого вещества в какое-либо другое вещество определенного химического состава, которое легко отделить и, взвесив, установить его вес. При рассмотрении методики и техники анализа следует особое внимание обратить на взятие средней пробы и подготовку вещества к анализу, взятие правильной и с достаточной точностью навески исследуемого вещества, выбор осадителя.
Приступая к выполнению анализа, нужно предварительно ознакомиться с аналитическими весами - важнейшим прибором, применяемым в весовом анализе, поэтому следует хорошо знать устройство весов и правила работы на них.
Наиболее важной операцией в гравиметрическом анализе является получение осадка, а затем гравиметрической формы. Надо хорошо понимать и усвоить вопросы теории осаждения и растворения осадков, уметь применить данные о произведении растворимости, о способах уменьшения растворимости, иметь представление об явлении соосаждения. В связи с этим следует знать требования, которым должны удовлетворять осадки, получаемые в гравиметрическом анализе, изучить методики анализа при получении кристаллических и аморфных осадков. Завершением гравиметрического анализа является вычисление результатов определений.
Пример 1. Предложить гравиметрический метод определения кальция в известняке и вычислить объем осадителя, если масса образца равна 0,2000 г. Определить массовую долю кальция в образце.
Необходимо гравиметрическим методом определить процентное содержание кальция в образце известняка, содержащем различные примеси. Одним из методов является осаждение кальция в виде оксалата - CaC2O4. Для проведения анализа точно отвешивают на аналитических весах определенное количество известняка, растворяют его в соляной кислоте, из раствора осаждают ионы кальция рассчитанным количеством раствора оксалата аммония. Полученный осадок оксалата отделяют фильтрованием, промывают, высушивают, прокаливают в муфельной печи при температуре 5000С и после охлаждения взвешивают. Осадок CaC2O4 - осаждаемая форма, прокаливанием при 5000С превращается в CaCO3, который в данном примере будет гравиметрической формой.
Таким образом, с содержащимся в известняке кальцием происходят следующие превращения:3 → Ca2+ → CaC2O4 → CaCO3
растворение - осаждение - прокаливание.
Пусть в качестве осадителя использован раствор (NH4)2C2O4 концентрации 18,0 г∙л-1. Количество оксалата аммония, которое необходимо для осаждения оксалата кальция из раствора, рассчитываем по уравнению реакции:
СaCO3 + (NH4)2C2O4 → CaC2O4 + (NH4)2CO3

 г/моль.
г/моль.
Количество молей CaCO3, взятого для анализа, равно mH/M(Na2CO3) или 0,2/100. Столько же нужно молей (NH4)2C2O4. Следовательно, количество оксалата аммония в граммах будет равно:
 г
г
и, учитывая, что необходимо применять полуторное количество осадителя, рассчитываем:(NH4CNS) = 0,248∙1,5 = 0,372 г.
Так как для осаждения используют раствор оксалата аммония, содержащий 18,0 г∙л-1, то такого раствора необходимо:
в 1000 мл - 18,0 г
в V мл - 0,372 г
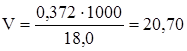 мл.
мл.
Такого рода расчеты достаточно проводить с точностью 2-3 значащие цифры. В то время как расчеты результатов анализа всегда проводят с точностью в 4 значащие цифры. Осадок CaC2O4 - осаждаемая форма - при прокаливании при температуре 5000С превращается в CaCO3. Масса осадка CaCO3 оказалась равной 0,1860 г. Определяем количество кальция в полученном осадке CaCO3: число молей кальция равно числу молей CaCO3.
Это же количество кальция содержалось в навеске известняка. Вычисляем % кальция в известняке:
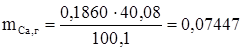 г
г

7. КОНТРОЛЬНЫЕ ЗАДАНИЯ по теме «Количественный анализ» (контрольная работа № 2)
. TNaCl = 0,005420 г/мл. Найти нормальность NaCl.
.  г/мл. Найти нормальность H2SO4.
г/мл. Найти нормальность H2SO4.
. TNaOH = 0,003882 г/мл. Найти нормальность NaOH.
. THCl = 0,003647 г/мл. Найти нормальность HCl.
. TNaCl = 0,005902 г/мл. Найти нормальность NaCl.
. TKOH = 0,05611 г/мл. Найти нормальность KOH.
.  г/мл. Найти
г/мл. Найти  .
.
. 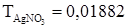 г/мл. Найти
г/мл. Найти 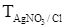 .
.
.  г/мл. Найти
г/мл. Найти  .
.
. 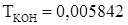 г/мл. Найти
г/мл. Найти  .
.
.  г/мл. Найти
г/мл. Найти  .
.
. 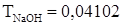 г/мл. Найти
г/мл. Найти 
.  г/мл. Найти
г/мл. Найти 
. Рассчитайте молярную массу эквивалента реагентов в реакции:
AlCl3 + 3NaOH → ↓Al(OH)3 + 3HCl.
145. Рассчитайте молярную массу эквивалента CrCl3 в реакции:
Cr3+ + H2O2 + OH- → CrO42- + H2O.
146. Рассчитайте: а) титр; б) молярную концентрацию; в) молярную концентрацию эквивалента; г) титр по йоду раствора, для приготовления 500,0 мл которого было взято 2,600 г дихромата калия.
. Сколько надо взять дихромата калия для приготовления 1 л раствора, каждый миллилитр которого соответствовал бы 0,01 г железа?
. 24,85 мл раствора KOH с TKOH=0,02806 г/мл оттитровывают 25,00 мл раствора HCL. Найти нормальность HCl.
. На титрование 25,00 мл раствора KOH расходуется 23,25 мл HCl с THCl=0,007352 г/мл. Найти нормальность раствора KOH.
. На титрование 20,00 мл раствора H2SO4 расходуется 21,55 мл NaOH с TNaOH=0,008110 г/мл. Найти нормальность H2SO4.
. На титрование 20,00 мл раствора NaCl требуется 18,25 мл 0,1140 н. AgNO3. Найти нормальность раствора NaCl.
. На титрование 25,00 мл раствора NaOH потребовалось 22,60 мл 0,9890 н. HCl. Найти нормальность раствора NaOH.
. На титрование 25,00 мл раствора KOH расходуется 28,40 мл 0,1265 н. H2SO4. Найти нормальность раствора KOH.
. Рассчитать объем, в котором надо растворить навеску бромата калия массой 0,4566 г, чтобы получить раствор с молярной концентрацией эквивалента 0,0500 моль/л.
. Вычислите массу навески дихромата калия для приготовления 250,0 мл раствора с концентрацией  моль/л.
моль/л.
. Какой объем дистиллированной воды и 0,6050 н. раствора серной кислоты требуется для приготовления 250 мл 0,0500 моль/л раствора?
. Какого объема мерную колбу следует взять для приготовления раствора йода, 10,00 мл которого соответствуют 0,04945 г As2O3, из фиксанала, содержащего в ампуле 0,01 м-экв йода?
. Смешаны следующие растворы дихромата калия: 200 мл раствора, содержащего в этом объеме 1,06 г K2Cr2O7, 400 мл 0,0365 М раствора и 250 мл 0,213 н. раствора; после этого смесь разбавлена до 1 л. Какова молярная концентрация полученного раствора в реакции окисления?
. На титрование 20,00 мл раствора щелочи израсходовано 19,10 мл раствора H2SO4 с  г/мл. Какова нормальность щелочи? Можно ли узнать ее титр?
г/мл. Какова нормальность щелочи? Можно ли узнать ее титр?
. На титрование раствора H2SO4 израсходовано 25,40 мл 0,2140 н. NaOH. Сколько граммов H2SO4 в растворе?
. На титрование соляной кислоты израсходовано 10,00 мл рабочего раствора NaOH с TNaOH/HCl=0,003874 г/мл. Сколько граммов HCl содержит раствор?
.  г/мл. Найти нормальность раствора для реакций, в которых перманганат превращается: в MnO2 и б) в MnSO4.
г/мл. Найти нормальность раствора для реакций, в которых перманганат превращается: в MnO2 и б) в MnSO4.
. Навеска Na2CO3 (х.ч.) 1,3540 г растворена в мерной колбе на 250 мл; раствор доведен до метки. Чему равен титр раствора: а) по Na2CO3 и б) по Na2O?
. На склянке написано: «KOH; T=0,005742 г/мл». Сколько граммов KOH содержится: а) в 10; б) в 25; в) в 100 мл раствора?
. Из навески KCl (х.ч.) 3,8260 г приготовлено 500 мл раствора. Каков его титр: а) по KCl; б) по Cl?
. Навеска железа (х.ч.) 2,8120 г растворена в соляной кислоте. Раствор доведен до объема 500 мл. Определить титр раствора: а) по Fe и б) по FeCl2?
. Сколько граммов йода содержится в 15,50 мл раствора, если титр его равен 0,01263 г/мл?
. Сколько граммов NaOH содержится: а) в 10; б) в 250; в) в 1000 мл раствора, титр которого по NaOH 0,004120 г/мл?
. На титрование израсходовано 26,75 мл раствора соляной кислоты, титр которой 0,003782 г/мл. Сколько граммов HCl израсходовано на взаимодействие с определяемым веществом?
. Сколько H2SO4 содержится: а) в 28,60 мл; б) в 12,54 мл раствора, титр которого 0,005146 г/мл?
. Титр раствора NaOH 0,04000 г/мл. Чему равен его титр по HCl?
. На титрование израсходовано 18,54 мл раствора NaOH, титр которого 0,003980 г/мл. Сколько граммов NaOH вступило в реакцию с определяемым веществом?
. Титр раствора AgNO3 0,01702 г/мл. Определить его титр по NaCl?
. Титр раствора HCl 0,03647 г/мл. Чему равен его титр по KOH?
. Навеску 0,2968 г х.ч. NaCl растворили в мерной колбе на 250 мл. Каков титр раствора по Ag?
.  г/мл. Найти
г/мл. Найти 
. Титр раствора KCl 0,003756 г/мл. Определить его титр по Ag.
. На титрование раствора NaOH израсходовано 20,00 мл рабочего раствора HCl с THCl/NaOH=0,00800 г/мл. Сколько граммов NaOH содержит раствор?
. Раствор содержит 2,8640 г KOH в 1 л. Чему равен его титр по H2SO4?
. На титрование раствора H2SO4 израсходовано 28,35 мл раствора KOH с  г/мл. Сколько граммов H2SO4 содержит раствор?
г/мл. Сколько граммов H2SO4 содержит раствор?
.  г/мл. Найти
г/мл. Найти  .
.
. На титрование раствора NaOH расходуется 20,00 мл раствора HCl с THCl/KOH=0,02820 г/мл. Сколько граммов NaOH содержит раствор?
.  г/мл. Найти
г/мл. Найти  .
.
.  г/мл. Найти нормальность раствора: а) для реакции обмена; б) для реакции окисления-восстановления, в которой дихромат калия превращается в CrCl3.
г/мл. Найти нормальность раствора: а) для реакции обмена; б) для реакции окисления-восстановления, в которой дихромат калия превращается в CrCl3.
. TKCl/Cl = 0,003674 г/мл. Найти нормальность.
. THCl/NaOH = 0,003984 г/мл. Найти нормальность.
. TKOH/HCl = 0,003465 г/мл. Найти нормальность.
. 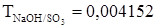 г/мл. Найти нормальность.
г/мл. Найти нормальность.
. 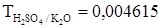 г/мл. Найти нормальность.
г/мл. Найти нормальность.
. 25,00 мл раствора HCl неизвестной концентрации требуют для титрования 23,30 мл раствора NaOH c  г/мл. Определить нормальность раствора HCl.
г/мл. Определить нормальность раствора HCl.
. Навеска известняка массой 0,1585 г растворена в кислоте, обработана избытком щавелевой кислоты. Полученный осадок отделен, промыт и растворен в серной кислоте. Раствор оттитрован 28,75 мл раствора KMnO4 с Т=0,002850 г/мл. Рассчитать массовую долю в % CaCO3 и CaO.
. К пробе, содержащей уксусную кислоту, прибавлено 40,00 мл раствора гидроксида натрия (ТNaOH=0,003901 г/мл). Избыток щелочи оттитрован 19,98 мл раствора серной кислоты (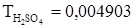 г/мл). Рассчитать количество граммов CH3COOH в пробе.
г/мл). Рассчитать количество граммов CH3COOH в пробе.
. Сколько надо взять 8,4%-го раствора H2SO4 для осаждения бария из 0,4859 г двуводного гидрата хлорида бария?
. К 0,2266 г хлористой соли прилили 30,00 мл 0,1121 н. раствора AgNO3, избыток которого оттитровали 15,00 мл 0,1158 н. NH4CNS. Вычислить % содержание хлора в образце.
. Определить процентное содержание (NH4)2C2O4∙H2O, если после растворения навески 0,2265 г к раствору добавлено 25,00 мл 0,1000 М раствора CaCl2, избыток соли кальция оттитрован 18,50 мл раствора комплексона III с титром по кальцию 0,002004 г/мл.
. На титрование 10,00 мл раствора йода с молярной концентрацией 0,0500 моль/л было затрачено 12,40 мл раствора натрия тиосульфата. Вычислить титр раствора натрия тиосульфата.
. Пробу соли аммония в 1,000 г обработали избытком концентрированного раствора гидроксида натрия. Выделившийся аммиак был поглощен 50,00 мл 1,072 н. HCl. Избыток кислоты был оттитрован 25,40 мл раствора гидроксида натрия (ТNaOH=0,004120 г/мл). Вычислить процентное содержание NH3 в образце.
. Навеску NaOH, загрязненного Na2CO3, растворили в воде и получили 100,0 мл раствора. На титрование аликвотной части объемом 10,00 мл было израсходовано в присутствии фенолфталеина 20,87 мл HCl с концентрацией 0,1373 моль/л. На титрование той же аликвоты в присутствии метил-оранжевого затрачено 21,54 мл. Вычислить m NaOH и m Na2CO3 в навеске.
. К раствору сульфата аммония было добавлено 25,00 мл раствора гидроксида натрия, ТNaOH=0,009021 г/мл. После удаления NH3 на титрование избытка гидроксида натрия пошло 6,30 мл раствора хлороводородной кислоты, ТHCl=0,007860 г/мл. Вычислить содержание (NH4)2SO4 в растворе.
. До какого объёма следует разбавить 350,0 мл раствора KMnO4 с молярной концентрацией эквивалента 0,2083 моль/л для получения раствора с титром по H2O2 равным 0,002174 г/мл?
. Определить процентное содержание фенола, если к навеске 0,5000 г добавлено 25,00 мл раствора 0,2000 н. KBrO3 и KBr (0,2000 н.). В результате реакции образуется C6H2Br3OH. После стояния добавлен KI. Выделившийся йод оттитрован 24,50 мл 0,1000 н. раствора Na2S2O3.
. Исследуемый раствор хлорида никеля разбавлен в колбе до 250 мл. К 10,00 мл этого раствора прибавлено 15,00 мл 0,0100 М трилона Б, избыток которого оттитрован 4,50 мл 0,0100 М сульфата магния. Рассчитать граммовое содержание никеля в исследуемом образце (в растворе).
. Рассчитать рН в точке эквивалентности и скачок титрования 20 мл 0,1 н. раствора СН3СООН ( ) 0,2 н. раствором КОН. Рассчитать индикаторную погрешность титрования с а) фенолфталеином, рТ=9, б) бромтимоловым красным, рТ=7.
) 0,2 н. раствором КОН. Рассчитать индикаторную погрешность титрования с а) фенолфталеином, рТ=9, б) бромтимоловым красным, рТ=7.
. На титрование навески оксалата натрия 0,1230 г израсходовано 18,00 мл раствора перманганата. Рассчитайте с(1/5KMnO4) и  .
.
. Подберите индикатор для определения конца титрования 0,1 н. раствора бензойной кислоты ( ) 0,1 н. раствором гидроксида натрия.
) 0,1 н. раствором гидроксида натрия.
. Навеску 4,856 г KCNS растворили в мерной колбе ёмкостью 500 мл. На титрование 25,00 мл раствора израсходовано 24,95 мл раствора Hg(NO3)2. Определить молярную концентрацию эквивалента и титр раствора Hg(NO3)2.
. Вычислить массовую долю % H2O2 в растворе, если на 15,00 мл (ρ=1,0 г/см3) его было затрачено 8,95 мл раствора KMnO4 с молярной концентрацией эквивалента 0,010 моль/л.
. Навеску (NH4)2Cr2O7 массой 0,1004 г обработали избытком иодида калия в кислой среде, а затем оттитровали раствором тиосульфата натрия. Расход титранта составил 22,54 мл. Вычислите молярную концентрацию раствора тиосульфата натрия.
. До какого объема следует разбавить 750,0 мл 0,1000 моль/л раствора K2Cr2O7 для получения раствора с титром по железу (II) равным 0,003839 г/мл.
. Образец, содержащий магний гидрокарбонат, массой 3,500 г растворили в подкисленной воде и оттитровали 12,05 мл раствора ЭДТА с молярной концентрацией 0,05 моль/л. Вычислите массовую долю магния гидрокарбоната в образце.
. Навеску дигидрата щавелевой кислоты массой 0,2000 г растворили в разбавленной серной кислоте, а затем после нагревания до 700 С оттитровали раствором KMnO4 в количестве 10,14 мл. Вычислите молярную концентрацию эквивалента титранта.
. Навеску хлорида калия массой 0,0600 г оттитровали 13,12 мл раствора нитрата серебра. Вычислите титр раствора титранта.
. 0,1000 г металлического цинка растворили в серной кислоте, а затем полученный раствор оттитровали 12,00 мл раствора ЭДТА.
. До какого объема следует разбавить 750 мл раствора K2Cr2O7 с молярной концентрацией эквивалента 0,1533 моль/л для получения раствора с титриметрическим фактором пересчета по Fe2+, равным 3,8390∙10-3 г/мл?
. До какого объема следует разбавить 350 мл раствора KMnO4 с молярной концентрацией эквивалента 0,2083 моль/л для получения раствора с титриметрическим фактором пересчета по H2O2, равным 2,174∙10-3 г/мл?
. Вычислите молярную концентрацию раствора HCl, если на титрование 0,0976 г Na2B4O7∙10H2O было затрачено 21,55 мл этого раствора.
. Рассчитать молярную массу эквивалента фенола в его реакции бромирования.
. Чему равна нормальность раствора тетрабората натрия декагидрата, если навеска массой 5,0053 г растворена в мерной колбе емкостью 500 мл?
. Установите формулу соединения, если получены следующие результаты элементного анализа: Fe - 44,09%; S - 55,91%.
. Рассчитайте содержание железа в руде, если из навески руды 0,7020 г получено 0,4344 г Fe2O3?
. Установите формулу соединения, если получены следующие результаты элементного анализа: Na2SO4 - 63,64%; H2O - 36,36%.
. 1 мл стандартного раствора тиосульфата натрия соответствует 4,903∙10-3 г дихромата калия. Навеску дихромата калия после добавления иодида калия и серной кислоты оттитровали 17,16 мл стандартного раствора Na2S2O3. Вычислите массу навески дихромата калия.
. Пробу массой 1,0737 г, содержащей только NaAsO2 и Na3AsO4∙12H2O растворили в мерной колбе вместимостью 100,0 мл. Аликвотную долю объемом 10,0 мл оттитровали 10,0 мл раствора йода с концентрацией c(1/zI2)=0,10 моль/л. Вычислите массу мышьяка в пробе.
. Навеску безводного сульфата магния массой 0,1030 г растворили в дистиллированной воде и затем оттитровали 9,55 мл раствора ЭДТА. Вычислите титриметрический фактор пересчета раствора ЭДТА по Ca2+.
. К 2,500 мл хлората калия было прибавлено 25,00 мл 0,1200 н. раствора сульфата железа (II), избыток которого оттитровали 5,00 мл 0,1100 н. раствора перманганата калия. Рассчитать процентное содержание хлората калия в растворе, если плотность его равна 1,020.
. К 20,00 мл 0,1000 М раствора NiSO4 прибавили 20,00 мл исследуемого раствора NaCN. Определить молярную концентрацию его, если на титрование избытка NiSO4 израсходовали 10,24 мл 0,05000 М раствора трилона Б. Продукт реакции - [Ni(CN)4]-2.
. На 50,00 мл раствора щавелевой кислоты при титровании расходуется 21,16 мл раствора КОН (ТКОН=0,01234). На 20 мл этого же раствора щавелевой кислоты требуется 19,67 мл раствора KMnO4. Рассчитать молярную концентрацию эквивалента раствора KMnO4.
. Сколько граммов KCl содержится в 250 мл раствора, если на титрование 25,0 мл его израсходовали 34,00 мл 0,01000 н. раствора AgNO3. Вычислить рCl и рAg 0,1 н. раствора KCl, оттитрованного на 85% 0,1 н. раствором AgNO3.
. Рассчитать рН раствора, полученного при титровании 20 мл 0,1 н. раствора муравьиной кислоты 0,1 н. раствором NaOH (КHCOOH=1,8∙10-4) в точках, соответствующих 99,9%, 100% и 100,1% оттитровки. Установить вид и знак индикаторной ошибки при использовании индикатора метилового красного (рТ=5,3).
. 25,00 мл раствора KMnO4 с титром по кислороду (О2), равным 0,008112 г/мл прибавили к раствору, содержащему избыток KI и кислоту. Выделившийся йод оттитровали 24,14 мл раствора тиосульфата натрия. Рассчитайте  .
.
. При анализе карбоната магния было определено 17,39% магния и 39,13% кристаллизационной воды. Сколько процентов магния содержится в абсолютно сухом образце?
. Сколько мл 0,05 н. раствора Na2S2O3 потребуется на титрование йода, выделившегося после прибавления избытка KI к 50 мл раствора, взятого из мерной колбы на 500 мл, где было растворено 2 г сплава, содержащего 60% меди?
. Сколько % оксида калия содержится в навеске массой 0,8500 г, если на титрование ее ушло 20,00 мл HCl с титром равным 0,003650 г/мл.
. Какую навеску цинковой руды, содержащей 15% Zn, следует взять для анализа, чтобы после растворения и отделения мешающих примесей цинк в ней оттитровался 20 мл 0,1 М раствора трилона Б.
. Какого объема мерную колбу следует взять для растворения 4,000 г сплава, содержащего 25% серебра, чтобы на титрование ионов серебра из 20,00 мл этого раствора затрачивалось 16,50 мл 0,1 н. раствора роданида с Т=0,4492 г/мл?
. Рассчитать рН при титровании 0,1 н. раствора бутиламина (С4H9NH2)  0,1 н. раствором хлороводородной кислоты в точке эквивалентности и в пределах между недостатком и избытком титранта 0,1% от эквивалентного количества. С каким индикатором следует проводить титрование бутиламина?
0,1 н. раствором хлороводородной кислоты в точке эквивалентности и в пределах между недостатком и избытком титранта 0,1% от эквивалентного количества. С каким индикатором следует проводить титрование бутиламина?
. Вычислить процентное содержание свинца, если после растворения навески 0,5433 г к раствору добавлено 25,00 мл K2CrO4. Осадок отфильтрован, промыт. К фильтрату добавлен KI, выделившийся йод оттитрован 15,20 мл 0,1000 н. раствора Na2S2O3, 1,00 мл хромата калия эквивалентен 1,20 мл раствора Na2S2O3.
. Из 3,206 г сплава осадили свинец в виде PbCrO4. Действием на осадок кислоты и йодида калия выделили йод, на титрование которого израсходовано 9,150 мл 0,1028 н. раствора Na2S2O3. Рассчитайте % содержание свинца в сплаве. Напишите уравнения реакций.
. Вычислить массу навески H2C2O4∙H2O, если при броматометрическом титровании было израсходовано 20,05 мл раствора KBrO3 с молярной концентрацией эквивалента 0,07000 моль/л.
. Рассчитать окислительно-восстановительный потенциал (по отношению к водородному электроду) системы в растворе, если к 20 мл 0,1 н. раствора Na3AsO3 добавили 18 мл 0,1 н. раствора I2 при рН=9.
. Рассчитать титр раствора азотнокислого серебра по бромид- и цианид-ионам, если известно, что на титрование 20,00 мл этого раствора израсходовано 16,40 мл 0,1000 н. хлорида калия.
. Азот из навески образца 0,5000 г восстановлен до аммиака, который пропущен через 50,00 мл раствора хлороводородной кислоты с титром по аммиаку 0,003400 г/мл. Избыток кислоты оттитрован 12,00 мл раствора гидроксида калия (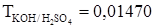 г/мл). Сколько процентов азота содержит образец?
г/мл). Сколько процентов азота содержит образец?
. Вычислить величину окислительно-восстановительного потенциала, если к 20 мл 0,1 н. раствора сульфата железа (II) добавлен 0,1 н. раствор перманганата калия в количестве
а) 19 мл, б) 21 мл [H+]=1, φ0(Fe3+/Fe2+)=0,77 B, φ0(MnO4-/Mn2+)=1,51 B.
. Исследуемое вещество может быть или КОН или NaOH. Для нейтрализации 1,10 г этого вещества потребовалось 31,4 мл 0,860 н. раствора HCl. Что это за вещество и сколько оно содержит примесей?
. При анализе хлорида бария было определено 56,22% бария и 14,73% кристаллизационной воды. Сколько процентов бария содержится в абсолютно сухом образце?
. Какая масса BaCl2 содержится в 250,0 мл раствора, если после прибавления к 25,00 мл его 40,00 мл 0,1020 М AgNO3 израсходовано 15 мл 0,09800 М NH4CNS?
. Сколько граммов меди обнаружено в растворе, если на титрование 10,00 мл уходит 18,90 мл 0,0200 М раствора трилона Б в присутствии индикатора мурексида? Чему равен титр этого раствора по кадмию?
. Из навески глины 0,5340 г после соответствующей обработки получено 0,2345 г CaO и 0,0235 г MgO. Рассчитать процентное содержание в глине CaCO3 и MgCO3.
. Сколько надо взять 1%-го раствора диметилглиоксима для осаждения никеля из навески 0,9531 г сплава, содержащего 0,5% никеля?
. До какого объёма следует разбавить 500,0 мл 0,1000 н. K2Cr2O7 для получения раствора с титром по железу 0,005000?
. Из навески 0,7124 г хлорида аммония при кипячении с концентрированным раствором щелочи выделен аммиак и поглощен 50,00 мл 0,5120 н. раствора серной кислоты. Полученный раствор перенесен в мерную колбу и разбавлен до 250 мл. 25,00 мл этого раствора оттитровали 25,7 мл 0,05122 н. раствором гидроксида натрия. Вычислить % содержание хлорида аммония в навеске.
. Смесь фосфорной кислоты и натрия хлорида массой 2,000 г растворили в воде и получили 100,0 мл раствора. На титрование аликвотной части объемом 10,00 мл было затрачено в присутствии фенолфталеина 15,66 мл раствора NaOH с молярной концентрацией 0,1637 моль/л. Вычислить массовую долю фосфорной кислоты в смеси в %.
. Определить процентное содержание фенола, если к навеске 0,5032 г добавлено 25,00 мл 0,2052 н. раствора бромата калия, содержащего бромид калия. В результате реакции образуется C6H2Br3OH. После стояния добавлен иодид калия, выделившийся йод оттитровали 24,56 мл 0,1006 н. Na2S2O3.
. Рассчитать минимальную навеску технического хлорида бария, содержащего 10% Ba, для определения его в виде BaSO4.
. На титрование раствора KCl расходуется 30,20 мл раствора AgNO3 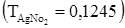 . Можно ли узнать его нормальность?
. Можно ли узнать его нормальность?
. В мерной колбе вместимостью 250,0 мл растворили 2,002 г технического KBr. К 25,00 мл раствора прибавили 50,00 мл 0,05560 н. Hg2(NO3)2 (fэкв=1/2). На титрование избытка Hg2(NO3)2 израсходовали 21,02 мл раствора NaCl (T=0,003522). Вычислить массовую долю (%) KBr в образце.
. К 25,00 мл раствора H2S прибавили 25,00 мл раствора йода с молярной концентрацией эквивалента 0,04873 моль/л, избыток которого оттитровали 5,17 мл раствора Na2S2O3 концентрации 0,07543 моль/л. Рассчитать массу H2S в 750,0 мл исходного раствора.
. В каком направлении будет протекать реакция между арсенатом натрия и иодидом калия: а) при концентрации ионов водорода 10 моль/л, б) при pH равном 8,3. Концентрации реагирующих веществ равны 1 моль/л.
. Вычислить окислительно-восстановительный потенциал системы при титровании 20 мл соли двухвалентного олова раствором KBrO3, молярная концентрация эквивалента обоих растворов равны 0,1 моль/л: а) 19,98 мл, б) 20,02 мл. φ0(Sn4+/Sn2+)=0,15 B, φ0(BrO3-/Br-)=1,45 B, [H+]=1 моль/л.
. Рассчитайте рН в точке эквивалентности и скачок титрования при титровании 20 мл 0,1 н. раствора аммиака  0,2 н. раствором HCl, в пределах между недостатком и избытком HCl, равным 0,1% от его эквивалентного количества.
0,2 н. раствором HCl, в пределах между недостатком и избытком HCl, равным 0,1% от его эквивалентного количества.
. Образец оксида цинка весом 2,036 г растворили в 50,00 мл раствора серной кислоты, избыток которой оттитровали 10,30 мл 1,020 М раствора гидроксида натрия. Найти процентное содержание оксида цинка в образце, если 1,00 мл раствора серной кислоты эквивалентен 1,185 мл раствора гидроксида натрия.
. К 25 мл хлорида кальция прибавили 40,00 мл 0,1005 н. раствора оксалата аммония. Полученный осадок отфильтровали, промыли ледяной водой, а избыток оксалата оттитровали раствором KMnO4, затратив 15,00 мл 0,02000 н. этого раствора. Определить содержание хлорида кальция в граммах.
. Постройте кривую титрования 25 мл 0,2 н. раствора бензойной кислоты 0,2 н. раствором гидроксида калия, если прибавлено 24,95; 25,05; 25,00 мл щелочи. Подберите индикатор.
. Сколько надо добавить раствора азотной кислоты с титром 0,006497 г/мл к 500 мл раствора этой же кислоты с титром 0,005601 г/мл, чтобы получить точно 0,1000 н. раствор?
. Вычислить молярную концентрацию эквивалента раствора нитрата серебра, если на титрование 36,48 мл его затрачено 25,63 мл раствора хлорида натрия, содержащего 58,00 г NaCl в 500 мл раствора. Рассчитать рAg и pCl в момент эквивалентности.
. Для определения титра раствора KMnO4 навеску оксалата натрия Na2C2O4 массой 1,3444 г поместили в мерную колбу на 200,0 мл. На титрование 20,00 мл этого раствора затрачено 20,04 мл раствора KMnO4. Рассчитайте: а) молярную концентрацию эквивалента KMnO4; б) титр KMnO4; в) титр KMnO4 по Na2C2O4.
. Вычислить рН растворов, когда к 20 мл 0,1 н. раствора HNO2  прибавлено 0,1 н. раствора КОН: а) 19,98 мл, б) 20,00 мл, в) 20,02 мл.
прибавлено 0,1 н. раствора КОН: а) 19,98 мл, б) 20,00 мл, в) 20,02 мл.
. Какую навеску вещества, содержащего 75% MnO2, надо взять для анализа, чтобы после взаимодействия ее с 30,00 мл 0,1075 н. раствора щавелевой кислоты избыток C2O42- мог быть оттитрован 5,00 мл раствора перманганата калия (1 мл раствора перманганата калия эквивалентен 1,325 мл раствора щавелевой кислоты).
. 1,500 г образца, состоящего из смеси Na2CO3 и NaHCO3, растворен в мерной колбе на 250 мл. На титрование 50,00 мл этого раствора с фенолфталеином затрачено 5,70 мл 0,2000 н. раствора HCl. На дальнейшее титрование того же раствора с метиловым оранжевым затрачено 20,80 мл 0,2000 н. раствора HCl. Рассчитать процентное содержание Na2CO3 и NaHCO3 в образце.
. Сколько мл 23,13% раствора гидроксида калия плотности 1,22 нужно прибавить к 1 л 0,980 н. раствора гидроксида калия, чтобы получить 1,00 н. раствор?
. На титрование раствора NaCl израсходовано 19,95 мл раствора AgNO3 с  . Сколько граммов Cl содержит раствор?
. Сколько граммов Cl содержит раствор?
. На титрование раствора H2SO4 расходуется 10,00 мл раствора KOH с  . Сколько граммов H2SO4 содержит раствор?
. Сколько граммов H2SO4 содержит раствор?
. 0,1 н. раствор уксусной кислоты  был нейтрализован 0,1 н. раствором NaOH на 80%. Рассчитать рН полученного раствора.
был нейтрализован 0,1 н. раствором NaOH на 80%. Рассчитать рН полученного раствора.
. Вычислить, какой объем раствора нитрата серебра концентрации 40 мг/мл потребуется для полного осаждения хлорид-иона, содержащегося в 1 г чистого хлорида натрия.
. К 2,00 мл раствора бромата калия прибавлено 25,00 мл раствора сульфата железа (II) с Т=0,01824 г/мл, избыток раствора сульфата железа (II) оттитровали 6,00 мл 0,1100 н. раствора KMnO4. Рассчитать процентное содержание бромата калия в растворе, если плотность его равна 1,120.
. Навеску 10,05 г Hg(NO3)2∙2H2O растворили в мерной колбе емкостью 250 мл. На титрование 20,00 мл раствора пошло 16,10 мл раствора NH4CNS ( г/мл). Вычислить процентное содержание Hg(NO3)2 в образце.
г/мл). Вычислить процентное содержание Hg(NO3)2 в образце.
. При каком рН следует закончить титрование 0,02 н. раствора муравьиной кислоты 0,04 н. раствором KOH. Выбрать индикатор. (КHCOOH = 1,8∙10 -4).
. Рассчитать область скачка на кривой титрования Fe3+ раствором Sn2+ при недостатке и избытке рабочего раствора в 0,1%. Молярные концентрации эквивалента растворов солей железа и олова равны между собой и составляют 0,1.
. Навеску натрия гидроксида, загрязненного Na2CO3 и индифферентными примесями, массой 0,6000 г растворили в 100,0 мл воды. Аликвотную часть 10 мл оттитровали раствором H2SO4 с молярной концентрацией 0,05220 моль/л. В присутствии фенолфталеина было затрачено 11,89 мл титранта, а в присутствии метилового оранжевого 12,79 мл. Вычислить массовые доли NaOH и Na2CO3 в образце.
. К раствору арсенита натрия добавлен NaHCO3 до рН=9 и 25,00 мл 0,0500 н. раствора йода. Остаток йода после тщательного перемешивания оттитрован 10,20 мл раствора тиосульфата с титром по дихромату 0,002496 г/мл. Какое количество граммов мышьяка находилось в исследуемом растворе?
. Вычислить процентное содержание CaCO3 и MgCO3 в известняке, если после растворения 1,000 г пробы и соответствующей обработки объем раствора довели до 100,0 мл и на титрование 20,00 мл его для определения суммы Ca и Mg затратили 19,25 мл 0,05140 М трилона Б, а на титрование Mg израсходовали 6,26 мл того же раствора трилона Б.
. Рассчитать скачок потенциала при титровании 0,1 М раствора церия (IV) сульфата раствором сульфата железа (II) концентрации 0,1 моль/л. (99,9% и 100,1% оттитровки).
. Определить молярную концентрацию эквивалента раствора серной кислоты, если к 10,00 мл раствора Н2SO4 добавлен избыток BaCl2. Осадок отфильтрован, промыт. К осадку добавлено 50,00 мл 0,05000 М раствора комплексона III, избыток последнего оттитрован 20,50 мл 0,04500 М раствора MgSO4.
. Рассчитать навеску стали, содержащей около 10% никеля, чтобы при комплексонометрическом определении его, после отделения с помощью реактива Чугаева, затратилось не более 20 мл 0,05 М раствора комплексона III.
. К сернокислому раствору KClO прибавили 30,00 мл раствора FeSO4 с молярной концентрацией 0,08425 моль/л, избыток которого оттитровали 10,13 мл раствора KMnO4 с молярной концентрацией эквивалента 0,09826 моль/л. Вычислить массу KClO в растворе.
. Сколько граммов оксалата магния растворится при промывании его а) 100 мл воды, б) раствором, 200 мл которого содержат 0,2 г щавелевой кислоты?
. Рассчитайте молярную концентрацию эквивалента и титр по аммиаку раствора хлороводородной кислоты, если на титрование 20,00 мл углекислого калия, полученного растворением навески 1,380 г в мерной колбе на 200 мл, расходуется 25,00 мл раствора хлороводородной кислоты.
. Рассчитать % магния в сплаве, если навеска его 0,5892 г. В результате анализа получено 0,0672 г пирофосфата магния.
. Вычислить молярную концентрацию эквивалента раствора нитрата серебра, если на титрование 36,48 мл его затрачено 25,63 мл раствора бромида натрия, содержащего 103,0 г в 500 мл раствора. Рассчитать рBr и pAg раствора AgNO3, оттитрованного на 99% и 101% раствором NaBr, если молярные концентрации эквивалента обоих растворов равны 0,1 моль/л.
. Вычислить содержание КОН и К2СO3 в растворе технического едкого калия, если этот раствор протитрован 0,0950 н. раствором HCl с применением двух индикаторов. Показания бюретки при титровании по фенолфталеину - 22,40 мл, показания бюретки при продолжении титрования из той же бюретки по метилоранжу - 25,80 мл.
Дата публикования: 2014-11-18; Прочитано: 3432 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
